日外会誌. 124(2): 177-182, 2023
特集
糖代謝異常と外科医療
6.膵全摘術後の血糖管理
|
東北大学大学院 医学系研究科外科病態学分野消化器外科学 海野 倫明 , 伊関 雅裕 |
膵全摘術後は膵内分泌機能廃絶のため膵性糖尿病は必発である.血糖低下作用を有するインスリンのみならず,血糖上昇作用を有するグルカゴンも喪失するため,血糖は乱高下し管理は困難である.近年,インスリンアナログの開発に伴い超速効型インスリンと持続型インスリン製剤が臨床に導入され,強化インスリン療法による厳密な血糖管理で,以前みられた低血糖発作など重篤な有害事象の頻度は減少したが未だ満足すべきものではない.近年,組織内グルコースセンサーとインスリンポンプ制御の発展により,持続血糖測定機能付きインスリンポンプ(SAP)療法が開発された.本療法は携帯型人工膵臓とも言える機能を有しており,本法により膵全摘術後の血糖管理はさらに改善するものと考えている.現在,東北大学では膵全摘術後患者に対する前向き臨床研究を開始している.
キーワード
膵全摘術, 血糖管理, 膵性糖尿病, 強化インスリン療法, SAP療法
I.はじめに
膵全摘術後は,血糖管理に最も重要なホルモンであるインスリンを産生するランゲルハンス島β細胞が完全に失われることから,膵性糖尿病になることは必発である.このため外部からその時々の血糖に見合った量のインスリンを導入することが求められる.また,通常の糖尿病とは異なり膵全摘術後は,血糖上昇作用を有するグルカゴンもその大部分を失うことから,血糖値の変動が大きく,インスリン投与により低血糖を来しやすいという特徴がある.このため,膵全摘後の血糖管理は極めて難しいとされている.
20世紀の時代,膵全摘を行うと血糖管理が困難になることから膵全摘は極力避けるべき,と言われていた.当時の血糖管理は,速効性インスリンとレンテ型インスリンを組み合わせた1日1回あるいは1日2回投与法が標準であり,その結果低血糖発作が頻発し,高血糖よりも低血糖で患者の生命が脅かされていた.また膵全摘の適応になるのは進行した膵癌であったが,術前後の補助化学療法もなく術前画像診断も十分ではなかった時代で,その治療成績は悲惨であったことも加わり,膵全摘は行ってはならない術式とされていた.事実,1988年の論文では,膵全摘を施行すると血糖が安定するのには1年かかり,また術後の就労率も低く,一方で予後の改善は認められないことから,膵全摘はごく限られた症例を除いて行うべきではない,と結論付けられている1).
21世紀に入り,様々な面で膵全摘術に対する考え方が変わり,必要であれば膵全摘を行うことを躊躇すべきではない,という時代になった.インスリン製剤の改良により血糖管理が著しく向上し,低血糖発作を起こしにくい強化インスリン治療ができるようになったことが一義的ではあるが,膵癌の治療成績が著しく改善し膵全摘により長期予後が望める症例が増加したこととも関係があると考えている.本小論では,膵全摘術の適応,インスリン製剤の発展,持続血糖測定機能付きインスリンポンプ療法(SAP療法)などについて触れる.
II.膵全摘術の適応
近年,各種画像診断の精緻化,切除可能性分類の導入,術前術後補助化学療法の標準化,コンバージョン手術などの概念の導入,などにより,膵全摘術に対する考え方が大きく変化した.以前は,膵全摘術を行わなければ治癒切除が得られないような巨大な腫瘍や,膵全体が悪性腫瘍であるような超高度進行癌が適応になることが多かったが,現在は精密な術前画像診断により遠隔転移を有するものが手術適応から外れ,また切除可能境界領域膵癌や局所進行切除不能膵癌に対しては,長期間の化学(放射線)療法が行われた後の一部の症例に対してのみ,コンバージョン手術が行われるようになった2).このように切除術自体の適応が厳格になったことから,通常型膵癌に対する膵全摘術は以前に比べて減少したものと思われる.
その一方で,IPMN(膵管内乳頭粘液腺腫瘍)の疾患概念の確立により,比較的予後が良好なIPMNに対する膵全摘術は増加した.特に主膵管から発生する主膵管型IPMNは膵管全長にわたり腫瘍細胞が観察されることが多く,その一方で治癒切除が行われれば,たとえadenocarcinomaが検出されても予後は比較的良好であり,膵全摘の良い適応と考える.また,IPMNに対する膵体尾部切除術後の再発に対する膵頭十二指腸切除術,あるいは膵頭十二指腸切除術後再発に対する膵体尾部切除,いわゆる二期的膵全摘術も,予後が良好であることから積極的に行われるようになった.
以上,膵全摘術の適応は,腫瘍側因子としては,膵癌術前治療後の切除可能膵癌のうち膵頭十二指腸切除あるいは膵体尾部切除を施行しても断端陽性となる腫瘍,切除可能境界領域・局所進行切除不能膵癌で術前治療が奏効しコンバージョン手術を行うもの,IPMN主膵管型で膵切除断端が陽性となるもの,残膵に発生した転移性あるいは異時性再発腫瘍で切除が可能なもの,などが挙げられる.その他膵全摘術が不可避な良性腫瘍,慢性膵炎の一部の症例,出血や膵炎を繰り返す膵動静脈奇形も膵全摘術の適応となろう.
一方,患者側因子としては,インスリンの必要性を十分に理解し自己インスリン注射が可能な患者,低血糖発作などの病態を理解し,またサポートできる家族がいること,などが条件となる.そのために,認知症の患者や超高齢の患者が適応になることは少ない.
III.インスリン製剤の進歩
バンティングとベストによるインスリンの発見の後,多くの製薬企業がインスリンの製剤化を進めたが,一昔前のインスリン製剤は家畜(ブタ・ウシ)の膵臓抽出液から作成されていた.これらは異種蛋白でありアレルギー反応やインスリン抗体の出現があり,ヒトインスリン製剤が熱望されていた.
1980年にヒトインスリン遺伝子のクローニングがなされ,その後の遺伝子工学の発展により速やかに製剤化が進み,1983年には初の遺伝子組み換えインスリンとしてHumalin®が発売された.これ以降,ほぼすべてのインスリン製剤がヒトインスリンに置き換わったが,ヒトインスリンは皮下で6量体を形成しており徐々に血中に放出され,効果が出現するのには30〜60分かかることから,より速やかに血中に放出される剤形が求められた3).
その後,ヒトインスリンの一部のアミノ酸を置換したインスリンアナログが開発され,10分以内に血糖を低下させる超速効型インスリンとしてインスリン・リスプロを成分とするヒューマログ®,インスリン・アスパルトを成分とするノボラピッド®,インスリングラルギンを成分とするアピドラ®が発売されるに至った.一方,ほぼ1日間効果が継続する持効型のインスリンアナログとして,ランタス®,レベミル®,トレシーバ®等が開発され,現在に至っている3).
これらの改良された超速攻型インスリンと持効型インスリンを組み合わせ,1日3〜4回投与を行う強化インスリン療法が膵全摘術後にも応用され以前より血糖コントロールは良好になったが,166例膵全摘症例を集めた全国調査の結果4)では,未だに術後6カ月で34%,術後1年で42%の患者に低血糖イベントが発生していることが明らかになり,より良い血糖コントロール法が求められている.
IV.膵全摘術の実際の管理
ここでは東北大学病院における実際の膵全摘術後管理を解説する.まず,膵全摘術を施行する可能性がある患者は術前から糖尿病専門医にコンサルトをしておく.
術直後の血糖管理であるが,集中治療室では安全管理のため,すべての術式に統一したプロトコールを用いている.術後の血糖値の測定は,140〜250mg/dlとなるまで3時間おきに行い,この範囲内に2回以上入っていることを確認後,6時間おきに測定する.再度140〜250mg/dLを逸脱した場合は,再度3時間おきに測定する.使用するインスリン製剤はヒューマリンR®を50単位/生理食塩水50mlの組成として1単位/mlに調節し,インスリン持続投与を行う.当院集中治療室での血糖管理プロトコールを表1に示す.
一般病棟帰室後は血糖測定を1日4検行っている.絶食時のインスリン投与は持効型インスリン(トレシーバ®)から開始する.空腹時血糖が200mg /dLを超える場合は2単位追加するなど,空腹時血糖にあわせて調節する.標準化スライディングスケールを表2に示す.
糖尿病専門医の診察は週1~2回行い,経口摂取の状況などを確認し,超速効型インスリン(アスパルト®)の調整・追加を行う.胃内容物排泄遅延などで絶食の際も持効型インスリンは継続する.また退院までに血糖測定・自己インスリン注射の手技を習得してもらっている.


V.SAP療法
近年,グルコースセンサー,コンピューター,AI(Artificial Intelligence)等の機器の発展に伴い,持続皮下インスリン注入療法(CSII:Continuous Subcutaneous Insulin Infusion)治療や,さらに持続血糖測定機能付インスリンポンプ(SAP:Sensor-augmented pump)療法が急速に進歩している5).
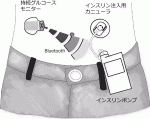
最新のメドトロニック社製のミニメド770Gシステム(図1)では,持続グルコースモニター(Continuous Glucose Monitor:CGM)により5分ごとに皮下組織中のグルコース濃度が測定され,Bluetoothトランスミッターを介してインスリンポンプ本体にグルコース値が送信される.ミニメド770Gインスリンポンプは,基礎インスリンを自動的に注入するのみではなく,組織内グルコース値を目標範囲内に保つようにインスリン量を自動調節し皮下に注入する.すなわちグルコース値が高値となることを予測するとインスリン注入量を増やし,低値になることを予測するとインスリンの注入量を減少または注入を停止させる.さらに食事を摂取する際は簡単なボタン操作でインスリンを追加投与することが可能である.これらの情報はすべてスマートフォンにも送信され,アプリを使用していつでも自分でグルコース値の変化などを見ることができる他,診察時に担当医は,観察期間内のグルコース値やインスリン注入量などをダウンロードして閲覧することが可能で,その後の治療に反映させることが可能である.
このように長所が多い治療法であるが,常にグルコースセンサーと皮下注入用のカニューラの装着が必要であること,保険適応ではあるが費用負担が若干多くなること,またこれらの装置の操作に興味を有し理解するインテリジェンスが必要,などが本治療法のリミテーションと思われる.
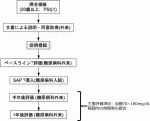
膵全摘術を受けた患者に対するSAP療法のメリット・デメリットは未だに明らかではない.そこでわれわれは「膵全摘術後患者の持続血糖測定機能付きインスリンポンプ(SAP)装着に関する前向き観察研究」(UMIN000034234)を開始した.本研究は,膵全摘後患者に対する持続血糖測定器付きインスリンポンプ装着の有効性と安全性について,血糖コントロールを主要評価項目として検討しようとするものである.対象は,膵全摘を施行され強化インスリン療法を6カ月以上施行され,血糖コントロールが不安定な20歳以上の患者で,予定症例数は30例である.主要評価項目は,血糖70~180mg/dL範囲内の時間帯の割合,副次的評価項目は,血糖値70mg/dLの時間帯,血糖値180mg/dL以上の時間帯,平均血糖,インスリン使用量,HbA1c,低血糖エピソード回数,The Center for Epidemiological Studies-Depression(CES-D)によるQOL評価,栄養指標の推移(In Bodyによる体重,骨格筋量,皮下脂肪厚,体脂肪量,血清アルブミン値,末梢血総リンパ球数,末梢血好中球数,CRP値,総コレステロール値,トランスサイレチン値,トランスフェリン値,レチノール結合蛋白値,コリンエステラーゼ)である.本研究のシェーマを図2で示す.
本研究により,膵全摘術後の血糖管理に対するSAP療法の有用性が明らかになると考えている.
VI.おわりに
膵全摘術後の血糖管理について概説した.膵全摘術は本論で述べたように内分泌機能の廃絶のため膵性糖尿病になるほか,膵外分泌機能廃絶のため蛋白・脂肪の吸収障害を発症するが,近年の高力価膵酵素補充療法により,こちらも克服されるようになった.これからの時代,膵全摘術が必要である症例に対しては後顧の憂い無く膵全摘が行うことができるよう,血糖のみならず,栄養,消化吸収の管理を行い,患者のQOLをさらに高めることが求められている.そのためには外科医と糖尿病内科,消化器内科との緊密な連携が必要であることは論を俟たない.
利益相反:なし
文献
1) 真辺 忠夫,平野 鉄也,野中 敦,他:拡大膵全摘術後の問題点.日消外会誌,21: 2492-2495,1988.
2) 元井 冬彦,伊関 雅裕,高館 達之,他:膵癌に対する膵全摘術の適応と成績.胆と膵,40: 11-16,2019.
3) 粟田 卓也:インスリン製剤の変遷をたどる.メディカル・ジャーナル社,東京,2013.
4) Suto H, Kamei K, Kato H, et al.: Risk factors associated with hypoglycemic events after total pancreatectomy: A nationwide multicenter prospective study in Japan. Surgery, 172: 962–967, 2022.
5) 庭野 史丸,馬場 谷成,廣峰 義久,他:膵全摘術後の膵内分泌機能異常.胆と膵,40: 75-79,2019.
PDFを閲覧するためには Adobe Reader が必要です。