日外会誌. 123(6): 553-560, 2022
特集
ロボット支援下手術の現況と展望
7. ロボット支援下手術の現状と展望 <心臓>
|
ニューハート・ワタナベ国際病院 心臓血管外科 石川 紀彦 , 堀川 貴文 , 瀬口 龍太 , 宮城 基 , 小圷 徹 , 木内 竜太 , 富田 重之 , 大塚 俊哉 , 渡邊 剛 |
心臓領域は他の領域と異なり内視鏡手術の導入が遅れていたが,手術支援ロボットの登場により可能になったと言える.ロボット心臓手術は大きく冠動脈バイパスと心内手術に分けることができ,バイパス手術では内胸動脈をポートのみで採取することで,小切開によるバイパス手術や完全内視鏡下のバイパス手術を実現する.しかし,ロボット手術が真価を発揮するのは特に心内手術であり,僧帽弁形成術は最も適した術式と言える.ロボット支援下僧帽弁形成術は,完全内視鏡下に行うことでその利点を最大限に生かす事が出来,より短い時間で正確かつ複雑な弁形成が可能になる点では正中切開手術やMICSをはるかにしのぐ.われわれは四つのポートのみで心内手術を施行しており,Keyhole cardiac surgeryと定義してその発展に努めている.
また,ロボット心臓手術の安全な普及に向けて「ロボット心臓手術関連学会協議会」を設置し,施設・術者の認定や教育を行っている.2018年に胸腔鏡下弁形成術としてロボット手術が保険収載され,症例数は年々増加しており,協議会の役割は重要なものとなっている.
今後は保険収載の拡大,新規ロボットの出現などが期待されるが,特に心臓外科領域では胸壁の破壊を回避しより正確な手術を実現するものであり今後の発展が期待される.
キーワード
ロボット, 心臓, 僧帽弁形成術, 冠動脈バイパス術, da Vinci
I.はじめに
ロボット支援下心臓手術の薬事申請は他領域とは異なり,海外のデータを利用せず国内での臨床治験を経て2015年に承認された.2005年に第一世代のda Vinci standard(Intuitive surgical社(米国))を個人輸入しロボット心臓手術を開始し,2008年には高度医療申請を行いロボット心臓手術を継続していたわれわれにとっては万感の思いがある.
II.心臓外科における低侵襲化
われわれは1999年に世界に先駆けて完全内視鏡下の心拍動下冠動脈バイパス術を施行し1),その後も内視鏡を用いた小切開冠動脈バイパス術等を多数報告してきた2)3).元来,心臓外科手術は心停止下に胸骨正中切開アプローチで行うものが標準術式とされてきたが,1993年頃より胸骨正中切開を回避したMICS(Minimally invasive cardiac surgery)と呼ばれる主に右肋間開胸アプローチによる心内手術や,人工心肺を用いない心拍動下冠動脈バイパス術(OPCAB:Off-pump coronary artery bypass)として低侵襲化されてきた.他領域が内視鏡手術を導入し低侵襲化が進む一方で心臓手術での導入が遅れていた理由は,対象とする臓器が拍動し迅速な手技を要すること,術野が狭いこと,繊細な縫合結紮を求められるなどの困難さゆえである.手術支援ロボットda Vinci surgical system(以下,da Vinci)の登場は心臓外科領域での安全な内視鏡手術を可能にしたといえる.
III.ロボット支援下心臓手術の実際
冠動脈バイパス術
虚血性心疾患に対する冠動脈バイパス術はda Vinciを用いて内視鏡下に内胸動脈を剥離した後,肋間開胸をおき直視下用手的に冠動脈吻合を行う方法と,吻合までもロボットを用いて行う完全内視鏡下冠動脈バイパス術(TECAB:Totally endoscopic coronary artery bypass)に大別される.ロボット支援下内胸動脈採取は,3箇所のポートより経胸腔的に剥離操作を行うもので,同時に両側内胸動脈を採取することも可能であり,これにより多枝バイパスも可能となる4)
~
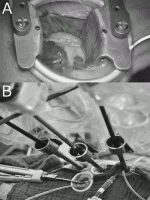
6).TECABは専用のスタビライザーを用いて行うが7),難易度は一気に増し世界でもルーティンに行っている施設は現在でもわれわれを含め数カ所しかない(図1)8)
~
11).
僧帽弁閉鎖不全症,心房中隔欠損症,心筋腫瘍などに対する心内手術
心内手術の中でも特に僧帽弁閉鎖不全症に対するロボット支援下僧帽弁形成術は極めて合理的な術式である.従来の正中切開よりもより側方からアプローチすることにより良好な視野のもと病変を拡大視が出来ることや,僧帽弁だけでなく左心室内の観察,弁下部の形成操作ができることなど大きな利点を有する.ロボット支援下僧帽弁手術は,完全内視鏡下に行うことでその利点を最大限に生かす事が出来,より短い時間で正確かつ複雑な弁形成が可能になる点では正中切開手術やMICSをはるかにしのぐ.
2018年4月にロボットを用いた胸腔鏡下弁形成術(1弁・2弁)が保険収載され,国内の症例数も一気に増加しており,その後の国内症例数は年次的に増加しており2021年は700例を超える心臓手術が実施され,そのうち僧帽弁形成術は600例を超えるものとなった.

VI.キーホールロボット心臓手術と小開胸ロボット心臓手術
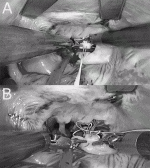
ロボットを用いた完全内視鏡下心内手術(キーホールロボット心臓手術)と小切開ロボット心内手術(MICSロボット心臓手術)とは大きな違いがある.5~7cmの小切開からアプローチしてロボットを使うのであれば,あえてロボットを使用する必要はない.他領域でロボット手術が発展したのは,2D内視鏡下で,自由度の少ない鉗子を用いる不自由な手術操作が,ロボット技術によって完全内視鏡下に正確かつ自在に行えるようになったためである.心臓手術も例外ではなく,MICSの小開胸でロボットを使用することにのみ意味を見出すのは外科医の自己満足であり,ロボット手術のメリットを十分に発揮できていない.MICSロボット手術は表面の切開創は5~7cmであっても実際は開胸器で肋間を拡大するため皮下筋層および肋間筋はさらに左右5cm程度切離しているのである(図2).
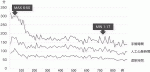
ロボット手術は初期導入時は正中切開の直視下手術と比較して糸の結紮や切離などにより時間を要するため手術時間,人工心肺時間,大動脈遮断時間が長くなる.しかし150例前後のラーニンカーブ(図3)を超えてしまえば四つのキーホール(鍵穴)だけで正確な弁の形成が可能となる(図4).われわれはさらに安全かつ迅速に手技を完遂するためにいくつもの工夫を加えて12)
~
16),手術時間の短縮を実現してきた.ただし,一般の外科医にとってはロボット手術の導入時に限りMCS創からアプローチし心内操作にロボットを用いることが安全上必要かもしれない.それでも左室内の観察などロボット手術の長所を幾分享受できる.しかしラーニングカーブに達したら完全内視鏡による手技を最終目標とすべきである.これが患者にとって最も低侵襲でありロボットのメリットを享受できる.
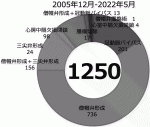
われわれTeam Watanabeではda Vinciを用いた心臓外科領域の手術を2005年より開始して以来17),2022年5月までに1,200例を超す症例を経験している.内訳は70%以上が僧帽弁形成術,他の術式として心房中隔欠損閉鎖術,心臓腫瘍摘出術,これに心房細動に対するMAZE手術などが併施されている(図5)18)
~
20).残りの約20%弱が冠動脈バイパス術である.初期例からほぼ全例ポートのみで手術を施行しており,これをKeyhole cardiac surgeryと定義し行っている.
ニューハート・ワタナベ国際病院ではロボット支援下心臓手術を2019年には196例,2020年は173例,2021年は195例を施行し術者別の心臓手術の件数としては世界第1位となった.僧帽弁形成術は159例(うち三尖弁形成術併施17例,メイズ併施20例,メイズおよび三尖弁形成術併施20例)施行し,手術時間162±28分,人工心肺時間112±19分,大動脈遮断時間66±14分であり,輸血症例は10例(6.3%)であった.現在,標準的な僧帽弁形術であれば手術時間2時間,大動脈遮断時間1時間,無輸血で終了する.これは一般の正中切開およびMICSでの僧帽弁形成術を凌駕する成績と考えている.
V.ロボット手術の問題点
一般的に手術支援ロボットの問題点としてロボット鉗子に感覚のフィードバックがないことがあげられているが21),1,200例を超える経験上,必要はないと考える.従来の手動の内視鏡鉗子でも30cm先の鉗子先端からのフィードバックはほとんどないし,外科医の経験とカメラが提供する術野映像からのフィードバックより多くの情報を得ることが可能である.視野から得られる視覚を触覚にフィードバックする“共感覚”の獲得は外科医自身の成長に大きく貢献する.
VI.今後の展望
ロボット心臓手術の安全な普及に向けて,日本胸部外科学会,日本心臓血管外科学会および日本ロボット外科学会が協力して「ロボット心臓手術関連学会協議会」を設置し,施設・術者の認定や教育を行っている.現在25施設がその認定を受けているが,コロナ禍で献体を用いたトレーニングが中止されていたため新たな施設認定は停滞していた.しかし2022年6月から国内での献体を用いたトレーニングが開始される事が決まり,今後新たにロボット心臓手術を開始する施設が順次増加していく予定である.
現在,ロボットをもちいた心房中隔欠損閉鎖術や弁置換術なども技術的には十分可能であるが,保険診療としての制約があり積極的に行えない.今後,保険収載の適応拡大が期待される術式としては弁置換術,心房中隔欠損閉鎖術,心臓腫瘍切除術などであり,これらの術式が保険収載されると,予定手術としての心内手術の大部分をロボット支援下に行い得る時代が来るものと考えられる.いずれの術式も胸骨正中切開,肋間開胸を回避し不必要な胸壁破壊を軽減できることから,合併症の軽減・輸血回避・早期退院および社会復帰に大きく寄与するが,結果的には医療費の削減にもつながるものとなる.
また,現在はda Vinciの独壇場となっている手術支援ロボットであるが,すでに各国で新しいコンセプトも含めた多くの手術支援ロボットの開発がされている.国内でも既にメディカロイド社よりhinotori surgical robot systemが上市されており今後の術式拡大が期待される.
VII.おわりに
手術支援ロボットの出現は外科全領域における更なる低侵襲手術を可能にした.特に心臓外科領域では完全内視鏡手術を実現するものであり今後の発展が期待される.
利益相反:なし
文献
1) Watanabe G, Takahashi M, Misaki T, et al.:Beating-heart endoscopic coronary artery surgery. Lancet, 25: 2131-2132, 1999.
2) Watanabe G, Misaki T, Kotoh K, et al.:Bilateral thoracoscopic minimally invasive direct coronary artery bypass using internal thoracic arteries.Ann Thorac Surg, 65: 1673-1675, 1998.
3) Watanabe G, Misaki T, Kotoh K, et al.:Multiple minimally invasive direct coronary artery bypass grafting for the complete revascularization of the left ventricle.Ann Thorac Surg, 68: 131-136, 1999.
4) Ishikawa N, Watanabe G, Iino K, et al.:Robotic Internal Thoracic Artery Harvesting. Surg Today, 37: 944-946, 2007.
5) Ishikawa N, Watanabe G:Ultra-minimally invasive cardiac surgery: robotic surgery and awake CABG. Surg Today, 45: 1-7, 2015.
6) Watanabe G, Matsumoto I, Kiuchi R:Novel Sternum Lifting Technique for Robotic Internal Thoracic Artery Graft Harvesting.Innovations (Phila), 8: 76-79, 2013.
7) Srivastava S, Gadasalli S, Agusala M, et al.:Use of Bilateral Internal Thoracic Arteries in CABG through Lateral Thoracotomy with Robotic Assistance in 150 Patients. Ann Thorac Surg, 81 : 800-806, 2006.
8) Nishida S, Watanabe G, Ishikawa N, et al.:Beating-heart totally endoscopic coronary artery bypass grafting: report of a case. Surg Today, 40: 57-59, 2010.
9) Balkhy HH, Nisivaco S, Kitahara H, et al.:Robotic Multivessel Endoscopic Coronary Bypass: Impact of a Beating-Heart Approach With Connectors. Ann Thorac Surg, 108: 67-73, 2019.
10) Bonatti J, Schachner T, Bonaros N, et al.:Ongoing procedure development in robotically assisted totally endoscopic coronary artery bypass grafting (TECAB). Heart Surg Forum, 8: 287-291, 2005.
11) Ishikawa N, Watanabe G, Horikawa T, et al.:Robot-assisted totally-endoscopic mitral valve plasty and coronary artery bypass grafting. Ann Thorac Surg, Apr 18:Online ahead of print, 2022.
12) Watanabe G, Ishikawa N:Use of Barbed Suture in Robot-assisted Mitral Valvuloplasty. Ann Thorac Surg, 99: 343-345, 2015.
13) Watanabe G, Ishikawa N:Alternative Method for Cardioplegia Delivery During Totally Endoscopic Robotic Intracardiac Surgery. Ann Thorac Surg, 98: 1129-1131, 2014.
14) Ishikawa N, Watanabe G:Figure 4 Knot: Simple Tying Technique for Robotic and Endoscopic Sutures. Innovations (Phila), 12: 152-153, 2017.
15) Seguchi R, Ishikawa N, Tarui T, et al.:A Novel Shape-Memory Monofilament Suture for Minimally Invasive Thoracoscopic Cardiac Surgery. Innovations (Phila), 14: 55-59, 2019.
16) Ishikawa N, Watanabe G, Tomita S, et al.:Japan’s First Robot-assisted Totally Endoscopic Mitral Valve Repair With a Novel Atrial Retractor. Artificial Organs, 33: 864-866, 2009.
17) Watanabe G:Successful Intracardiac Robotic Surgery:inbitial results from japan.Innovations (Phila), 5: 48-50, 2010.
18) Tarui T, Ishikawa N, Horikawa T, et al.:First Major Clinical Outcomes of Totally Endoscopic Robotic Mitral Valve Repair in Japan -A Single-Center Experience. Circ J, 25: 1668-1673, 2019.
19) Ishikawa N, Watanabe G, Tarui T:No-touch aorta robot-assisted atrial septal defect repair via two ports. Interact Cardiovasc Thorac Surg, 26: 721-724, 2018.
20) Ishikawa N, Watanabe G, Tomita S, et al.:Robot-assisted minimally invasive direct coronary artery bypass grafting. ThoraCAB. Circ J, 78: 399-402, 2014.
21) Amirabdollahian F, Livatino S, Vahedi B, et al.:Prevalence of haptic feedback in robot-mediated surgery:a systematic review of literature. J Robot Surg, 12: 11-25, 2018.
PDFを閲覧するためには Adobe Reader が必要です。