日外会誌. 123(3): 262-269, 2022
特集
本邦の大腸癌治療の現状と展望―海外における標準治療と比較して
8.多発肝転移の手術適応と術式
|
防衛医科大学 校外科学講座 岸 庸二 |
肝転移個数は簡便に評価可能な強力な予後因子であり,4〜5個以上の症例では化学療法を先行することが一般化しつつある.これまでに,切除可能な大腸癌肝転移を対象として,upfront hepatectomyに対して術前化学療法の優位性,また,肝切除単独に対して術後補助化学療法の優位性を,全生存期間において証明した無作為化比較試験は存在しない.しかし,肝病変が進行した症例でも,化学療法と併用しながら,二期的肝切除や同時転移での肝切除先行といった工夫により,長期生存を得ることができる.また,肝切除後無再発生存期間と全生存期間には乖離があり,再肝切除を含む再発後治療が果たす役割の大きさを示唆している.肝臓外科医は,技術的な切除可否にとらわれがちだが,肝転移はStageⅣ大腸癌であることを認識し,原発巣の病理学的因子,KRASやBRAFなどの遺伝子変異,術前化学療法の奏功度など,肝転移個数や腫瘍径以外の予後因子も踏まえ,切除適応を判断する必要がある.薬物治療の成績は年々向上しており,切除不能から可能へconversionとなる症例はさらに増えてくることが予測されるが,complete responseが得られる機会は限られている.多発肝転移に対しては,手術単独でも,化学療法単独でも根治に至ることは稀であり,診断時,再発時,いずれにおいても集学的アプローチを追求する姿勢が大切である.
キーワード
大腸癌肝転移, 転移個数, 術前化学療法, Conversion, 再肝切除
I.はじめに
昨今の報告では,切除不能大腸癌に対する薬物治療後,肝転移に対する切除後の5年生存率が,それぞれ約20%,約50%とされ,大腸癌肝転移に対する積極的な肝切除は長期生存に寄与していることは明らかである.しかし,転移すなわち「Stage Ⅳの大腸癌」であり,特に多発肝転移例では,根治切除後の早期再発,とりわけ残肝再発率が高く,再発後治療の役割も大きいことも踏まえ,切除の適応並びに術式を決めることが望まれる.
本稿では,特に多発肝転移に対する治療方針を決めるうえで考慮すべき事項をまとめた.
II.予後因子としての転移個数
肝転移に限らず,腫瘍個数はあらゆる悪性疾患で予後因子とされている.大腸癌取扱い規約においては,肝転移のステージをH1,最大径 ≤ 5 cmかつ,腫瘍個数4個以下;H3,最大径 > 5 cmかつ5個以上;H2,H1とH3以外と定義されている1).Beppuらは,国内の多施設研究で肝切除2,220例を解析し,腫瘍径よりも個数の方が予後に与える影響が大きいとし,H1,5cm以下の単発転移; H3,腫瘍径を問わず,5個以上の転移;H2,H1とH3以外とする,新たなH分類を提唱し,特にH2 vs. H3の予後の層別化が改善したとしている2).
個数については,技術的な切除可否より,腫瘍学的に切除が適切かという観点での判断基準に用いられるのが一般的である.切除不能(unresectable)の定義は曖昧であり,術者の技量,血管再建をどこまで行うかといった方針により変わり得る.最近では,upfront surgeryが“適切(optimal)か”という言葉が広く用いられ,臨床試験のeligibility criteriaにも使用されている3).概ね,腫瘍個数4~5個以上を,not optimal for upfront resectionと定義していることが多い.
III.個数以外の予後因子
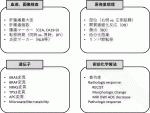
肝臓外科医は,肝腫瘍条件のみに目を奪われがちであるが,大腸癌の生物学的悪性度も考慮する必要がある.図1に,これまでに報告されてきた,肝切除術前に評価可能な予後因子を列挙した.
肝転移腫瘍径, 個数,CEAに加えて,原発巣のリンパ節転移,無再発期間などが古典的なものである.原発巣局所の因子として,大腸癌取扱い規約の記載事項にも含まれる簇出(budding)の他,低分化胞巣(poorly differentiated clusters),癌間質反応(desmoplastic reaction)が肝切除後の予後を予測することが,多施設研究の結果も含めて報告されている4)5).これらの因子が肝切除後の再発形式とも関連し,未熟な間質,高度の簇出や低分化胞巣を呈するほど,肝外再発が多いことや4)5),原発巣の簇出の程度が残肝再発に対する再肝切除後の予後まで予測することも示されている6).
各種遺伝子変異や,microsatellite instabilityなどもよく知られた予後因子である7).KRAS,BRAF変異の有無は抗EGFR抗体薬適応の判断に使用されるが,KRAS変異症例では,肝内微小転移の頻度が高いため,十分なsurgical marginを取る切除が望ましいとする報告もあり,術式選択の指標となる可能性もある8).
原発巣の部位(右側結腸vs.左側結腸)が予後因子であるかについては,議論が分かれているが,最近の国際多施設研究で,KRAS wildの症例においてのみ,右側結腸原発の肝転移の方が左側原発より有意に予後不良であったとの結果が示された9).
好中球数/リンパ球数比などの炎症マーカーも,予後因子とされるが,生物学的根拠,炎症マーカーを下げることが予後改善に寄与するかなど,未だ不明な点は多い10).
術前化学療法施行例では,病理学的奏功度は予後因子であり11),術前画像では,通常,RECIST基準に基づいて奏功度を判断することが多いが,特にBevacizumab使用例では,腫瘍径の縮小よりも,均質な低濃度構造への形態状の変化(morphologic response)12)の方が病理学的奏功度や予後をより適切に反映するとされる.MRI拡散強調像におけるADC値の低下が良好な予後を予測するとの報告もある13).
IV.肝切除前後化学療法の位置づけ
上述した通り,特に4〜5個以上の肝転移症例に対しては,術前化学療法が妥当な治療方針として受け入れられている.少なくとも,再発率の高さから,手術単独で根治を得られる可能性は低く,根治のためには集学的アプローチは不可欠である.一方これまでに,切除可能症例において,upfront surgeryに比較して術前化学療法の優位性を証明した無作為比較対照試験は存在しないことも事実である.術前化学療法の意義の一つにpatient selectionがある.LiverMetSurveyという国際データベースをもとにした,術前化学療法後に肝切除を施行した2,143例の解析結果では,化学療法中の腫瘍増悪(PD)症例175例の5年生存率は35%で,非PD1,968例の45%より不良(P<0.0001)であった.一方,PD症例でも,肝転移診断時のCEA<200ng/ml,転移個数2個以下,腫瘍径<50mmであれば,5年生存率53%であり,PDが切除の絶対非適応とすべきではないと結論づけている14).
術後補助化学療法についても,肝切除単独に対する全生存期間の優越性を示した比較試験は未だない.最近本邦より発表された,手術単独群 vs. 術後補助UFT/LV投与群15),手術単独群 vs. 術後mFOLFOX6併用群の無作為化比較対照試験(JCOG0603)16)いずれにおいても,無病再発期間は術後補助療法施行群で有意に良好であったものの,全生存期間に有意差は認めなかった.UFT/LV試験のサブグループ解析では,無再発生存期間延長効果は,同時性肝転移,多発肝転移症例で認められた.JCOG試験は中間発表であり,補助化学療法群には,初期の第Ⅱ相試験におけるmFOLFOX6完遂割合が36%しかない39例が含まれているなどの諸問題が指摘されている.また補助化学療法群で全生存期間が劣る傾向にあった理由として,化学療法施行後の再発は生物学的悪性度が高い可能性,再発後の再切除率や化学療法レジメンが両群間で異なる可能性などが指摘されているが,短期間で打ち切りとなっている症例も多く,追加解析の結果も望まれる.
V.肝切除術式
肝細胞癌と異なり,転移性肝癌では,R0にさえできれば,系統切除にこだわる必要はないとの考えが一般的である.一方で,虚血領域の残存は,グリソン枝が末梢で離断されているため,胆汁漏のリスクが高まるが,残肝再発のリスクも高まるという報告が最近され17),さらなる検証が望まれる.肝腫瘍が肝内主要脈管に接している場合,被膜に覆われた肝細胞癌では,被膜と血管との間を剥離する操作は許容されるが,被膜を有しない腺癌においては,剥離はR1切除となるため,血管合併切除(+再建)が妥当な術式となる.Viganoらは,血管からの剥離部位でのR1切除は,肝実質離断面での腫瘍露出と比較して,局所再発率は低く,全生存期間もR0切除例と差はないため,許容されるとしている18).肝静脈合併切除再建の安全性,有効性に関する報告はあるが,血管剥離した症例と長期成績を比較したものはなく,今後の課題の一つである.
二期的肝切除
二期的肝切除(two staged hepatectomy[TSH])は,肝両葉転移に対して,片葉部分切除→対側葉切除を行い,必要に応じて,2期目手術の前に門脈塞栓術(portal vein embolization[PVE])を追加する.通常は術前化学療法が併用される.適応基準はかなりの施設間格差があり,実際,ほとんどが欧米からの報告である.本邦からのまとまった報告が少ないのは,多発肝転移であっても,後述するように,再肝切除の可能性を考慮してできる限り肝実質を温存する術式が一般的である所以と推測する.図2に示すような,左葉病変は肝辺縁に限局し,右葉病変は多発もしくは門脈右枝に接するなどの純粋にTSHの適応となる症例に遭遇する機会は頻繁ではない.Associating Liver Partition and Portal vein ligation for Staged hepatectomy(ALPPS)は,特に右三区域切除術が想定される場合において,一期目手術として切除肝側の門脈枝結紮に肝実質離断を加えることにより,日単位の急速な非切除肝(future liver remnant, FLR)の肥大が得られ,2週間程度で二期的肝切除が可能になる,究極の術式である.当初,胆汁漏に起因する感染性合併症のリスク,12%という高い死亡率が問題視された19).その後,症例の集積に伴い短期成績は向上し,昨年には,22施設からの510例を解析し,90日死亡率が4.9%,5年前生存率33%という成績が報告された20).有効な治療として位置づけられてきたが,Langらが総説で“ALPPS certainly does not replace other techniques such as PVE or standard TSH, but may allow tumor resection in selected patients without any other surgical option left.”と述べているように21),最終手段であるという捉え方が重要である.PVEに切除側の肝静脈塞栓を追加することでFLR肥大効果を高める,liver venous deprivation(LVD)法が最近注目されるようになった22).ALPPS124例とLVD85例を後ろ向きに比較したフランスの多施設共同研究では,FLRの肥大速度はALLPS群の方が速いものの,肥大率は同等,また,切除率(肝切除遂行し,90日以上生存)はALPPSの方が優れている(90.6% vs. 72.6%)との結果を示している.LVD群には肝細胞癌や肝門部領域胆管癌症例が30%程度(ALPPS群は5%程度)と,背景の違いがあるものの,大腸がん肝転移症例のみの解析(ALPPS,73例;LVD,72例)でも,切除率は93.2% vs. 79.2%と,ALPPS群の方が優れていた.大腸癌肝転移において,LVD群の非切除の原因は腫瘍増悪が最も多く,切除(73例 vs. 58例)後の90日死亡は有意差は無いものの,5例(6.8%)vs. 1例(1.7%)と,ALPPS群に多い23).結語には,PVEによるFLR肥大不足を補うものとして両者は並列に扱うべき,と述べられているが,ALPPSは,数週間で切除不能が懸念される症例に対して,慎重に適応を判断すべきと考える.
Liver First approach
肝病巣が進行している同時肝転移症例において,肝切除のタイミングを逸しないために,Menthaらにより2006年に報告されたのが始まりである.2~6コースの化学療法後に効果判定をして,肝切除から行うというもので,20例中16例で,原発巣切除まで施行し,4年生存率61%と報告している24).最近,上述のLiverMetSurveyに登録された12,744例の同時肝転移症例をもとに,Liver-first,552例を,Primary-first,4,415例,同時切除, 2,393例と比較した後ろ向き試験の結果が報告された25).Liver-First群は他の2群と比べ,直腸原発が多い,肝転移腫瘍径が大きい,個数も多いという背景因子の差があり,単発肝転移,片葉多発,両葉多発と,三つのサブグループで解析を行っている.両葉多発転移症例においては,Liver-First群の90日死亡率,全合併症発生率,感染性合併症発生率とも,Primary-first群とは同等であったが,同時切除群よりは有意に低かったとしている.予後については,傾向スコアマッチングを行い,両葉多発転移例においてのみ,Liver-first群の全生存率が,Primary-first群,同時切除群より良好であったとしている25).「原発巣のコントロールをしてから転移の治療」という固定観念もあってか,本邦ではあまり普及してはいないが,肝転移巣のコントロールが予後規定因子になると推測される症例は度々経験され,選択肢の一つではある.
再肝切除
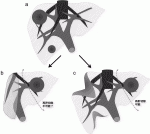
Allardらは,LiverMetSurveyのデータをもとに10個以上の肝転移症例529例を解析し,R0切除例の5年無再発生存率8%に対し,5年総生存率は45%と報告している26).この乖離は,再発後治療の有効性を示唆しているが,再肝切除の効果も含まれる.尤も,再肝切除が長期予後に寄与しているとの報告には,“再肝切除が可能な再発”というselection biasがかかっている.諸報告での再肝切除率は,再初例のせいぜい50%程度である.図3
27)のごとく,再切除の可能性を高めるためには,出来る限り肝実施を温存する術式(Parenchyma sparing hepatectomy,PSH)が望ましいことが想定される28).一方,最近報告されたPSHと,Extended hepatectomyを比較したメタ解析では,PSHの方が術後合併症の頻度は有意に少ないものの,無再発生存期間,全生存期間は同等としている29).化学療法のレジメンも増えつつあり,再発症例に対しても,化学療法によって切除不能→可能となる機会は期待できる.再肝切除は癒着の程度によって,技術的困難さ,出血のリスクも高まるが,再発後でも積極的に集学的治療を継続する意義は大きい.
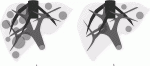
VI.おわりに
多発肝転移を念頭に,切除適応,術前後治療の位置付け,術式の選択肢について最近の知見を中心に紹介した.
大腸癌肝転移切除後の5年生存率50%は,切除施行した集団全体における数字であり,両葉多発や,切除不能からのconversionなど,条件が悪い集団に限れば,せいぜい30%台で,決して満足できる成績ではない.分子標的治療薬,免疫チェックポイント阻害薬など,薬物治療の発展は目覚ましく,conversion率は今後さらに高まると期待されるが,complete pathologic responseが得られる機会は限られている.根治のために肝切除が果たす役割は依然大きく,外科医には,TSH,再肝切除,血管合併切除などリスクの高い術式にも安全に対応できる知識と技術を培っておくことが求められる.
利益相反
奨学(奨励)寄附金:大鵬薬品工業株式会社
文献
1) 大腸癌研究会編:大腸癌取扱い規約.金原出版,東京,2018.
2) Beppu T, Imai K, Honda G, et al.: Proposal of a novel H category-based classification of colorectal liver metastases based on a Japanese nationwide survey. J Hepatobiliary Pancreat Sci, 28: 317-326, 2021.
3) Folprecht G, Gruenberger T, Bechstein W, et al.: Survival of patients with initially unresectable colorectal liver metastases treated with FOLFOX/cetuximab or FOLFIRI/cetuximab in a multidisciplinary concept (CELIM study). Ann Oncol, 25: 1018-1025, 2014.
4) Ueno H, Konishi T, Ishikawa Y, et al.: Histologic categorization of fibrotic cancer stroma in the primary tumor is an independent prognostic index in resectable colorectal liver metastasis. Am J Surg Pathol, 38: 1380-1386, 2014.
5) Ueno H, Konishi T, Ishikawa Y, et al.: Prognostic value of poorly differentiated clusters in the primary tumor in patients undergoing hepatectomy for colorectal liver metastasis. Surgery, 157: 899-908, 2015.
6) Noro T, Nishikawa M, Hoshikawa M, et al.: Prognostic Impact of Budding Grade in Patients With Residual Liver Recurrence of Colorectal Cancer After Initial Hepatectomy. Ann Surg Oncol, 27: 5200-5207, 2020.
7) Diener MK, Fichtner-Feigl S: Biomarkers in colorectal liver metastases:Rising complexity and unknown clinical significance? Ann Gastroenterol Surg, 5: 477-483, 2021.
8) Zhang Q, Peng J, Ye M, et al.: KRAS Mutation Predicted More Mirometastases and Closer Resection Margins in Patients with Colorectal Cancer Liver Metastases. Ann Surg Oncol, 27: 1164-1173, 2020.
9) Margonis GA, Amini N, Buettner S, et al.: The Prognostic Impact of Primary Tumor Site Differs According to the KRAS Mutational Status:A Study By the International Genetic Consortium for Colorectal Liver Metastasis. Ann Surg, 273: 1165-1172, 2021.
10) Kishi Y, Kopetz S, Chun YS, et al.: Blood neutrophil-to-lymphocyte ratio predicts survival in patients with colorectal liver metastases treated with systemic chemotherapy. Ann Surg Oncol, 16: 614-622, 2009.
11) Blazer DG 3rd, Kishi Y, Maru DM, et al.: Pathologic response to preoperative chemotherapy:a new outcome end point after resection of hepatic colorectal metastases. J Clin Oncol, 26: 5344-5351, 2008.
12) Chun YS, Vauthey JN, Boonsirikamchai P, et al.: Association of computed tomography morphologic criteria with pathologic response and survival in patients treated with bevacizumab for colorectal liver metastases. JAMA, 302: 2338-2344, 2009.
13) Uutela A, Ovissi A, Hakkarainen A, et al.: Treatment response of colorectal cancer liver metastases to neoadjuvant or conversion therapy:a prospective multicentre follow-up study using MRI, diffusion-weighted imaging and (1)H-MR spectroscopy compared with histology (subgroup in the RAXO trial). ESMO Open, 6: 100208, 2021.
14) Vigano L, Capussotti L, Barroso E, et al.: Progression while receiving preoperative chemotherapy should not be an absolute contraindication to liver resection for colorectal metastases. Ann Surg Oncol, 19: 2786-2796, 2012.
15) Hasegawa K, Saiura A, Takayama T, et al.: Adjuvant Oral Uracil-Tegafur with Leucovorin for Colorectal Cancer Liver Metastases:A Randomized Controlled Trial. PloS one, 11:e0162400, 2016.
16) Kanemitsu Y, Shimizu Y, Mizusawa J, et al.: Hepatectomy Followed by mFOLFOX6 Versus Hepatectomy Alone for Liver-Only Metastatic Colorectal Cancer (JCOG0603):A Phase II or III Randomized Controlled Trial. J Clin Oncol, 39: 3789-3799, 2021.
17) Yamashita S, Venkatesan AM, Mizuno T, et al.: Remnant Liver Ischemia as a Prognostic Factor for Cancer-Specific Survival After Resection of Colorectal Liver Metastases. JAMA Surg, 152:e172986, 2017.
18) Vigano L, Procopio F, Cimino MM, et al.:Is Tumor Detachment from Vascular Structures Equivalent to R0 Resection in Surgery for Colorectal Liver Metastases? An Observational Cohort. Ann Surg Oncol, 23: 1352-1360, 2016.
19) Schnitzbauer AA, Lang SA, Goessmann H, et al.: Right portal vein ligation combined with in situ splitting induces rapid left lateral liver lobe hypertrophy enabling 2-staged extended right hepatic resection in small-for-size settings. Ann Surg, 255: 405-414, 2012.
20) Petrowsky H, Linecker M, Raptis DA, et al.: First Long-term Oncologic Results of the ALPPS Procedure in a Large Cohort of Patients With Colorectal Liver Metastases. Ann Surg, 272: 793-800, 2020.
21) Lang H, Baumgart J, Mittler J: Associated Liver Partition and Portal Vein Ligation for Staged Hepatectomy (ALPPS) Registry:What Have We Learned? Gut and liver, 14: 699-706, 2020.
22) Guiu B, Chevallier P, Denys A, et al.: Simultaneous trans-hepatic portal and hepatic vein embolization before major hepatectomy:the liver venous deprivation technique. Eur Radiol, 26: 4259-4267, 2016.
23) Chebaro A, Buc E, Durin T, et al.: Liver Venous Deprivation (LVD) or Associating Liver Partition and Portal Vein Ligation for Staged Hepatectomy (ALPPS)?:A Retrospective Multicentric Study. Ann Surg, 274: 874-880, 2021.
24) Mentha G, Majno PE, Andres A, et al.: Neoadjuvant chemotherapy and resection of advanced synchronous liver metastases before treatment of the colorectal primary. Br J Surg, 93: 872-878, 2006.
25) Giuliante F, Vigano L, De Rose AM, et al.: Liver-First Approach for Synchronous Colorectal Metastases:Analysis of 7360 Patients from the LiverMetSurvey Registry. Ann Surg Oncol, 28: 8198-8208, 2021.
26) Allard MA, Adam R, Giuliante F, et al.: Long-term outcomes of patients with 10 or more colorectal liver metastases. Br J Cancer, 117: 604-611, 2017.
27) 岸 庸二:大腸がん肝転移の切除限界:“Possible” versus “Optimal”.防衛医大誌,45: 77-86, 2020.
28) Mise Y, Aloia TA, Brudvik KW, et al.: Parenchymal-sparing Hepatectomy in Colorectal Liver Metastasis Improves Salvageability and Survival. Ann Surg, 263: 146-152, 2016.
29) Deng G, Li H, Jia GQ, et al.: Parenchymal-sparing versus extended hepatectomy for colorectal liver metastases:A systematic review and meta-analysis. Cancer Med, 8: 6165-6175, 2019.
PDFを閲覧するためには Adobe Reader が必要です。