日外会誌. 123(1): 85-88, 2022
定期学術集会特別企画記録
第121回日本外科学会定期学術集会
特別企画(7)「≪外科学再興特別企画≫癌に対する免疫治療New Era」
3.腸内細菌を介したがん免疫微小環境へのアプローチ
|
1) 昭和大学 臨床薬理研究所臨床免疫腫瘍学部門 吉村 清1)2) , 角田 卓也2) (2021年4月10日受付) |
キーワード
腸内細菌, がん免疫微小環境, 免疫チェックポイント, メタゲノム解析, 短鎖脂肪酸
I.はじめに
ヒトの腸内には,およそ1,000種類,100兆個の細菌が共生し,腸内細菌叢を形成している.この腸内細菌叢がバランスを崩すと,炎症性腸疾患,リウマチ疾患,肥満症,糖尿病などをひきおこす.この状態はディスバイオーシス(dysbiosis)と呼ばれがんの病態にも密接に関係すると考えられている1).
腸内細菌叢の解析は,次世代シークエンサーの登場により,大きな進歩を生み出した.数百万塩基対で構成される細菌のゲノムには,「16SリボゾーマルRNA領域」という約1,600塩基対の多型性のある領域が存在している.16SリボゾーマルRNA領域には,数十から百塩基対程度で構成される9か所の超可変領域が存在し,細菌の種類により特徴的な配列を有している.細菌ゲノムの16S領域の全長,もしくは一部を読み取り,解析することで細菌種の同定が可能である.
便からの遺伝子抽出・精製,遺伝子増幅,増幅産物の精製・定量,ライブラリー作成,シークエンシング,そして解析ソフトを使用しての細菌の同定と割合の算出まで,数日間で終了する.
ヒト腸内細菌叢の形成は誕生直後に形成され始める.新生児期に形成された腸内細菌叢は,生涯を通じて不変的なものではなく,構成する細菌の組成は加齢とともに変化する2).これらは在胎期間や分娩形態,授乳形態などのさまざまな環境因子による影響を受けることが報告されている3).上記で述べたディスバイオーシスの研究により,腸内細菌におけるいわゆる善玉菌と悪玉菌がバランス良く存在することが大事で,主に偏性嫌気性細菌(obligate anaerobic bacteria;発酵菌)を善玉菌と呼び,通性嫌気性細菌が悪玉菌と呼ばれることが多かったが近年の研究の進歩により,必ずしもこの法則が当てはまらないため,善玉菌と悪玉菌と呼ぶ呼称そのものが使われにくくなってきている.われわれはがん患者の予後や再発と腸内細菌の関係などの解析において良い細菌と悪い細菌を図にまとめた(図1).

II.抗生物質の腸内細菌への影響
がんの分野では,がん免疫療法の治療効果と高い相関があるのではないかと考えられるデータが出ている4)
~
6).また,食道がんや胃がんをはじめ多くの臓器のがんに腸内細菌が関与しているのではないかとも考えられている7).
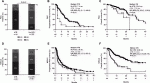
興味深いデータとして抗生物質の投与が腸内細菌に免疫チェックポイント阻害剤(ICI)の治療効果に対して負の影響を強く与えるという論文が有り注目されている(図2)8).
腎細胞がん,非小細胞肺がんの免疫チェックポイント阻害剤による治療患者の全生存率,無増悪生存率,全奏効率において検討され,図に示すようにいずれにおいても,有意差を持って抗生剤非投与群が上回る結果となった.実際には尿路上皮癌でも同様の結果が示されたため,がん種を越えて,抗生剤が免疫チェックポイント阻害剤の有効性を阻害する可能性がある.
III.抗PD-1抗体やがんへの腸内細菌の関与
ICIへの腸内細菌の影響は,Routy9),Matson10),Gopalakrishnan11)らが,特定の腸内細菌が抗PD-1抗体の臨床効果を修飾する可能性を報告している.しかし,各グループの報告した腸内細菌叢はそれぞれ異なっており特定されていない.また国や食生活で腸内細菌叢のパターンは異なっている.
腸内細菌が抗腫瘍効果に関与する際の主な作用機序として単鎖脂肪酸が知られている.単鎖脂肪酸はその受容体の違いなどから作用が変わると考えられるがその詳細は今後の研究によって明らかになっていくものとみられる12).
特にプロピオン酸,酢酸,酪酸などがこの代表であるが詳細は未だ不明な部分が多い.制御性T細胞の誘導,タイプ1型ヘルパーT細胞の誘導,腸管上皮細胞の増殖維持等,ヒトの免疫・生体恒常性維持に重要な役割を担っている12).
今後も個別の短鎖脂肪酸によるがん免疫に与える影響に対する機構解明に向けた研究が必要と考えられる.
IV.おわりに
今回,腸内細菌叢とICIの研究を中心に述べた.腸内細菌叢は離乳期から小学校低学年生の時期に主たる細菌叢の成分を形成する骨格が形成されると考えられている.また細菌は,飲食したものに付着する形で供給されると同時に,腸内ほどではないが多様性と細菌数を有する口腔内細菌叢からの供給もあると考えられる.口腔内は腸内と違って酸素が存在するため,好気性の細菌が大半を占める細菌叢を形成しており,嫌気性中心の腸内とは全く違ったデータが得られる.
現在,チェックポイント阻害剤同士の複合療法を始め化学療法との複合療法などの治療効果とirAEにおける腸内細菌叢や口腔内細菌叢との関連性を見いだすこと目的として様々な研究がされており,われわれも取り組んでいるが,世界中で研究が進行している.
今後のICI治療の展開に関して,便移植の研究を含め,腸内細菌叢の解析はますます重要となると考えられる.
利益相反
役員・顧問職:テルモ株式会社
講演料など:協和キリン株式会社,ブリストル・マイヤーズ スクイブ株式会社,中外製薬株式会社
研究費:第一三共株式会社,株式会社GCリンフォテック
奨学(奨励)寄附金:大塚製薬株式会社,協和キリン株式会社,塩野義製薬株式会社,EAファーマ株式会社,中外製薬株式会社
文献
1) Cani PD : Gut microbiota - at the intersection of everything? Nat Rev Gastroenterol Hepatol, 14: 321-322, 2017.
2) Arboleya S , Binetti A , Salazar N , et al.: Establishment and development of intestinal microbiota in preterm neonates. FEMS Microbiol Ecol, 79: 763-772, 2012.
3) Backhed F , Roswall J , Peng Y , et al.: Dynamics and Stabilization of the Human Gut Microbiome during the First Year of Life. Cell Host Microbe, 17: 852, 2015.
4) Vetizou M , Pitt JM , Daillère R , et al.: Anticancer immunotherapy by CTLA-4 blockade relies on the gut microbiota. Science, 350: 1079-1084, 2015.
5) Sivan A , Corrales L , Hubert N , et al.: Commensal Bifidobacterium promotes antitumor immunity and facilitates anti-PD-L1 efficacy. Science, 350: 1084-1089, 2015.
6) Wang Y , Wiesnoski DH , Helmink BA , et al.: Fecal microbiota transplantation for refractory immune checkpoint inhibitor-associated colitis. Nat Med, 24, 1804-1808, 2018.
7) Schwabe RF , Jobin C : The microbiome and cancer. Nat Rev Cancer, 13: 800-812, 2013.
8) Derosa L , Hellmann MD , Spaziano M , et al.: Negative association of antibiotics on clinical activity of immune checkpoint inhibitors in patients with advanced renal cell and non-small-cell lung cancer. Ann Oncol, 29: 1437-1444, 2018.
9) Routy B , Le Chatelier E , Derosa L , et al.: Gut microbiome influences efficacy of PD-1-based immunotherapy against epithelial tumors. Science, 359: 91-97, 2018.
10) Matson V , Fessler J , Bao R , et al.: The commensal microbiome is associated with anti-PD-1 efficacy in metastatic melanoma patients. Science, 359: 104-108, 2018.
11) Gopalakrishnan V , Spencer CN , Nezi L , et al.: Gut microbiome modulates response to anti-PD-1 immunotherapy in melanoma patients. Science, 359: 97-103, 2018.
12) Sun M , Wu W , Liu Z , et al.: Microbiota metabolite short chain fatty acids, GPCR, and inflammatory bowel diseases. J Gastroenterol, 52: 1-8, 2017.
PDFを閲覧するためには Adobe Reader が必要です。