日外会誌. 123(1): 53-60, 2022
特集
Modern Surgeon-Scientistによる恒常性維持器官の外科研究
8.小児がんのリキッドバイオプシー研究
|
1) 広島大学 自然科学研究支援開発センター 檜山 英三1)2) , 兒島 正人1)2) , 栗原 将2) , 佐伯 勇2) , 原田 隆範1) |
小児がんは,その治療成績が次第に向上しており,正確な診断のもとで的確な治療を行うことが必須となっている.こうした中で,的確な診断を行うためには従来の外科的切除や生検にとってかわって,血液中の循環腫瘍細胞(CTC)や遊離核酸(cfDNA)を用いたリキッドバイオプシーが用いられる時代になりつつある.われわれは,全血中の有核細胞から特異的抗体を用いたセルソーティングによってCTCを分離している.さらに,分離したCTCを直視下に採取し,遺伝子増幅法による遺伝子変異解析や発現解析を行うとともに,一細胞解析によって代謝解析を行っている.これらから,CTCには様々な細胞があり,腫瘍のheterogeneityを示すとともに,腫瘍内の抗悪性度の細胞や治療抵抗性の細胞の検出に有用と考えられた.一方,cfDNAを用いた解析は,肝芽腫のCTNNB1遺伝子変異,腎芽腫のWT1変異の検出,さらに神経芽腫のMYCN増幅の検出が可能となっており,臨床応用に至っている.将来,これらのリキッドバイオプシーは,外科的切除による病理診断をサポートするとともに,治療効果や再発のモニタリングにも有用な検査法となると考えられる.
キーワード
小児がん, 循環腫瘍細胞, 遊離核酸, 診断, 腫瘍マーカー
I.はじめに
小児がんは,成人がんとは異なり,本邦では年間に2,000から2,500人程度の発症で,その中の約1/3が造血器腫瘍であり,固形腫瘍となるとさらに少ない.近年の治療法の進歩により,全体の70~80%が治癒する時代となってきている.即ち,正確な診断の基に的確な治療を施行すれば治癒が期待されることを示している.その正確な確定診断のためには,腫瘍を切除あるいは生検して病理学的な組織診断が必須である.しかし,生検を行うためには,全身麻酔が必要で,小児固形悪性腫瘍の中で比較的多い副腎や傍脊柱にある交感神経幹から発症する神経芽腫や肝,腎にできる肝芽腫,腎芽腫などは,体の中心部に発生し,生検は必ずしも容易ではない.
さらに,発症数が少ない小児がんは,その中に100種以上のがん種が存在し,すべてが希少がんであるとともに,その多くが小円形細胞で病理学的な鑑別が必ずしも容易でない症例が少なくない.こうした背景から小児の病理診断においても分子診断が積極的に取り入れられているのが現状である.生検は診断のゴールドスタンダードであるものの,小児においては全身麻酔が必要なことと,腹部や胸部,あるいは頭蓋内などアプローチが容易でない場所に発生することが少なくないことから,診断時にはかなり大きな腫瘤を形成していることもあり,生検自体が出血や腫瘍破裂などのリスクのある診断法となる場合がすくなくない.また,生検のリスクを軽減する目的でコアニードルによる穿刺生検が試みられているが,これも麻酔を要するだけでなく,手術的生検に比べリスクが少ないとも言えない1)2).
最近,担癌患者の血液中には腫瘍細胞巣すなわち循環腫瘍細胞(CTC:Circulating Tumor Cell)と,遊離核酸特に遊離DNA(cfDNA:circulating free DNA)やmicro RNA(miRNA)が存在し,これらを用いた診断法が試みられるようになり,リキッドバイオプシーと呼ばれてている(図1)3)4).小児においては,麻酔が不要であることや繰り返し検査ができるなどの利点があり,さらに腹水や胸水中の腫瘍細胞や遊離DNAへの応用の可能で,これらの診断への応用が試みられるようになってきた5).

II.リキッドバイオプシー検体の採取方法
1)循環血液細胞(CTC)の採取
成人において,末梢血を20~50ml採取してCTCを採取している方向が多い6)が,小児がん患者は,5ml程度のEDTA加採血で十分なことが多い.小児は,成人にくらべ,体重当たりの心拍出量が多く,循環血液量も多いこと,さらに,見つかったときの腫瘍が体重比でかなりの容積があることなどが原因と考えている.全血から,リンパ球を含む有核細胞成分を密度勾配媒体による遠心分離法で採取し,これらの中から,CTCと考えられる細胞をフローサイトメトリー(FACS)で採取する(図2,図3).できれは,腫瘍特異的抗体を用いてソーティングすることが好ましく,神経芽腫が疑われればGD2抗体とCD90抗体を用いて選別して,ソーティングをかけている.分離されたCTCはそれぞれ一つずつソーティングし,プレートまたはチューブに入れて保管する7).
われわれは,その一部を,ナノスプレーチップ(Cellomics Tip)で吸引し,後述する質量分析で直接解析する一細胞解析を行っている(図3).
また,CTCが多数分離されたときは,走査電顕用の細胞を固定して,その形態観察を試みている.
2)腫瘍由来遊離核酸(cfDNA)の採取
遊離DNA(cDNA)は,血漿でも血清からでも採取可能であるが,血清は分離過程で血球成分が破壊されこれらの核酸が遊離してくることがあり,血漿からの抽出が望ましい.無論,血液採取後に長期にそのまま保存されると,有核細胞からのDNAが流出してcfDNAになるため,採血後速やかに分離し,分離した血漿は凍結保存しておけばその後にcDNAの採取は可能である.通常の核酸抽出法でも容易にcfDNAは回収できるが,専用の抽出キットも存在する.抽出されたcfDNAは分断されていて数十から数百ベースの断片として回収される8)
~
10).

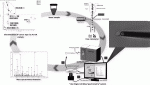
III.循環血液細胞(CTC)の解析の実際
CTCの回収は,必ずしも全例から可能ではなく,早期例や腫瘍容積の小さなもの,悪性度の低い腫瘍の場合は,回収ができないことも多い.一方で,進行例や多発転移例などでは,5mlの血液検体から数百個のCTCが分離されることもある.
CTCからは,通常,ゲノム解析,遺伝子発現解析,代謝産物解析を行い,多数のCTCが採取されれば走査電顕で観察している.
1)CTCのゲノム解析(Whole genome amplification:WGA)
1個のCTCのゲノム解析を行うには,ゲノムを増幅してその後に解析する必要がある.全ゲノムの増幅法(WGA)には様々な方法が今まで試みられている11)が,当科でもいくつかの方法を試みた結果,ランダムプライマーにphi29 DNAポリメラーゼを用いたMultiple displacement amplification(MDA)法が効率よく,またもとのDNAを反映した増幅が得られるようである.その確認法とし,特定の遺伝子数個(当科では8個)のRT-PCRを行い,それらのCT値がすべて設定値以下のものを解析に用いている.
実際には,通常のがん遺伝子パネルを用いて検索し,組織由来のDNAからみられた遺伝子変化に加えて,新たな遺伝子変化を見出されるCTCも存在し,腫瘍のheterogeneityを示唆している症例もみられている.
2)CTCの遺伝子発現解析(Whole transcriptome amplification:WTA)
1個のCTCの遺伝子発現解析を行う際も,mRNAを何等かの方法で増幅して,それぞれの遺伝子の発現の差をみることになる.これらの増幅法にもいくつかの方法があり,当科での検討では,The PCR-based WTA using template switching with locked nucleic acid法が,最も相同性が高かった12).この方法は,ポリAプリマ―によるcDNA作成後の対側のテンプレートスイッチング(TS)プライマ―の3ʼ末端にリボグアノシンを3個配列させることで増幅の特異性を上げています.この方法によって増幅されたcDNAを用いて,RNAシークエンスを行ったことで,CTCの中である程度のクラスター分離が可能で,CTCの中でも悪性度の違うCTCが混在していることが示唆された(図4).
3)CTCの網羅的代謝産物解析
CTC内の代謝産物の解析は,増幅は不可能であり,広島大学が開発した一細胞解析法を応用している.CTCを吸引したCellomics Tipに数μLの溶媒を加えた後,同じ溶媒が入った別の容器にCellomics Tipの先端を浸け,ソニケーションを超音波ホモジナイザーUR-20P(トミー精工Ⓡ)を用いて行い,そのまま,質量分析装置はQ Executive(Thermo Fisher Scientific)を用い,nanoESIイオン源にCellomics Tipをセットし,スプレー電圧1kV,ポジティブイオンモードで測定している.解析にはMarkerView(AB SCIEX)を用い,主成分分析とt-検定を行った.また,Human Metabolome Database(HMDB)を参照して候補化合物の絞り込みを行った.可視化に一CTC細胞をナノスプレーチップに吸引し,そのまま質量分析器にて直結させて解析する.その結果,CTCに特異的なマーカーである嫌気的解糖系酵素の上昇や神経芽腫ではカテコラミン代謝物などが見出されている(図5)5)7)13).
4)CTCの形態
採取されたCTCを走査型電顕で観察した.明らかにがん細胞と考えられ,ソーティング後に可視下で採取したこれらの細胞がCTCであることが示された(図6).



IV.腫瘍由来遊離核酸解析の実際
1)cfDNA解析
小児腫瘍では,血漿由来cfDNAの採取はCTCに比べ容易であり,臨床応用もされつつある.成人領域では,すでにcfDNAを用いたパネル検査が保険適応されていて,小児がんにおいても利用は可能な状況で,有効な薬剤選択のツールとなりつつある.さらに,小児がんにおいてはその特徴的な変異であるCTNNB1(βカテニン遺伝子)変異,腎芽腫のWT1変異や神経芽腫のALK変異などが見いだされれば診断的価値は高い.また,神経芽腫の悪性度の指標として有用なMYCN遺伝子増幅は,われわれの研究室ではすでにDroplet PCRでの定量的な検出が可能となっており,腫瘍のコピー数をほぼ反映するデータが得られている(図7).
2)miRNA解析
血中のmiRNAを分離してその解析が試みられ,いくつかの小児がんに応用されつつある.中でも,胚細胞腫瘍に関してはα―フェトプロテインよりも,miR-371a-3p,miR-372-3p,miR-373-3p,and miR-367-3pなどが 鋭敏なマーカーとして注目され,検討がすすんでいる14)15).

V.考察
小児がんは,多段階発がんによって生じてくる成人がんに比べ,遺伝子異常が少ないことがしられていて,最近の網羅的な全ゲノム解析においてもゲノム上の遺伝子異常の数は明らかに少ない.これは,小児がんが多段階発現の上に発症せず,元来,細胞分裂能が高く未熟な芽細胞に,遺伝子変異が起きたために悪性化して小児がんが発症している.そのために,遺伝子変異は成人がんのように多くはないが,その少数の遺伝子変異は疾患特異的で,それらが診断や悪性度の指標となることを物語っている.
こうした中で,小児がん領域おいて,病理診断だけは診断や治療方針が決めかねる場合や現在のように病理診断後に分子診断が行われる手順が,診断時の血液検体からすぐに分子診断できるメリットは大きい.やはり,CTCと遊離核酸(cfDNAとmiRNA)の2群に大別される.遊離核酸は分離が容易であり,遺伝子変異やmiRNA発現は既に評価も可能となり,診断や悪性度診断に応用可能なところまできている.
一方,CTCに関しては,これを確実に分離することのハードルが高く,特異抗原のある腫瘍では分離が容易であるが,それが明らかでない腫瘍では分離採取が容易でない場合もある.われわれは,直視下にCTCを観察して,これをナノスプレーチップに吸引して分析するとともに,細胞形態も電顕で確認している.これらが,確実に行えるようになれば,極めて有用な診断ツールになる.遺伝子増幅法のほぼ確立しており,一細胞解析の代謝分析に加えて遺伝子変異や発現解析は,治療選択に有用である.また,腫瘍のheterogeneityの検討も可能で,腫瘍内で存在するより悪性度の高い細胞や治療抵抗性の腫瘍の存在も把握できる.
また,cfDNAも含めて,治療中や治療後にも解析可能であり,治療効果や再発の診断にも有用なツールになると考えられる.実際には,神経芽腫症例のcfDNAでのMYCN増幅が腫瘍切除後に3日程度で検出されなくなることを確認している.
VI.おわりに
リキッドバイオプシーは,急速に臨床応用されてきており,成人領域では既にパネル検査では保険適応となっている.生検が容易でない小児がんにおいては,極めて有用なツールとなる.これらは,診断,治療選択のみならず,薬剤感受性,治療抵抗性を直接診断できるてんでは,通常の生検の枠を超えたリキッドバイオプシーとして発展することが期待される.
利益相反:なし
文献
1) Overman RE, Kartal TT, Cunningham AJ, et al.: Optimization of percutaneous biopsy for diagnosis and pretreatment risk assessment of neuroblastoma. Pediatr Blood Cancer, 67(5): e28153, 2020.
2) Pondrom M, Pariente D, Mallon B, et al.: Tumor rupture in hepatoblastoma:A high risk factor? Pediatr Blood Cancer, 67(9):e28549. 2020.
3) Schwarzenbach H, Hoon DS, Pantel K: Cell-free nucleic acids as biomarkers in cancer patients. Nat Rev Cancer, 11(6): 426-437, 2011.
4) Pailler E, Adam J, Barthelemy A, et al.: Detection of circulating tumor cells harboring a unique ALK rearrangement in ALK-positive non-small-cell lung cancer. J Clin Oncol, 31(18): 2273-2281, 2013.
5) Hiyama E, Ali A, Amer S, et al.: Direct Lipido-Metabolomics of Single Floating Cells for Analysis of Circulating Tumor Cells by Live Single-cell Mass Spectrometry. Anal Sci, 31(12): 1215-1217, 2015.
6) Cherdyntseva NV, Litviakov NV, Denisov EV, et al.: Circulating tumor cells in breast cancer: functional heterogeneity, pathogenetic and clinical aspects. Exp Oncol, 39(1): 2-11, 2017.
7) Abouleila Y, Onidani K, Ali A, et al.: Live single cell mass spectrometry reveals cancer-specific metabolic profiles of circulating tumor cells. Cancer Sci, 110(2): 697-706, 2019.
8) Kojima M, Hiyama E, Fukuba I, et al.: Detection of MYCN amplification using blood plasma:noninvasive therapy evaluation and prediction of prognosis in neuroblastoma. Pediatr Surg Int, 29(11): 1139-1145, 2013.
9) Kurihara S, Ueda Y, Onitake Y, et al.: Circulating free DNA as non-invasive diagnostic biomarker for childhood solid tumors. J Pediatr Surg, 50(12): 2094-2097, 2015.
10) Mussolin L, Burnelli R, Pillon M, et al.: Plasma cell-free DNA in paediatric lymphomas. J Cancer, 4(4): 323-329, 2013.
11) Huang L, Ma F, Chapman A, et al.: Single-Cell Whole-Genome Amplification and Sequencing: Methodology and Applications. Annu Rev Genomics Hum Genet, 16: 79-102, 2015.
12) Porras TB, Kaur P, Ring A, et al.: Challenges in using liquid biopsies for gene expression profiling. Oncotarget, 9(6): 7036-7053, 2018.
13) 檜山 英三,原田 隆範,兒島 正人:一細胞質量分析を用いた循環腫瘍細胞解析の試みAn Attempt to Analyze Circulating Tumor Cells Using Single-Cell Mass Spectrometry. 質量分析,68(2): 33-37, 2020.
14) Kremer L, von Brandenstein M, Wittersheim M, et al.: The combination of microRNA-371a-3p and 375-5p can distinguish viable germ cell tumor and teratoma from necrosis in postchemotherapy retroperitoneal lymph node dissection specimens. Transl Androl Urol, 10(4): 1647-1655, 2021.
15) Murray MJ, Scarpini CG, Coleman N: A Circulating MicroRNA Panel for Malignant Germ Cell Tumor Diagnosis and Monitoring. Methods Mol Biol, 2195: 225-243, 2021.
PDFを閲覧するためには Adobe Reader が必要です。