日外会誌. 123(1): 39-46, 2022
特集
Modern Surgeon-Scientistによる恒常性維持器官の外科研究
6.糖鎖―レクチン結合を用いた新規がん治療法の開発
|
筑波大学 消化器外科 小田 竜也 , 下村 治 , 高橋 一広 , 土井 愛美 , 宮崎 貴寛 , 古屋 欽司 , 大和田 洋平 , 小川 光一 , 大原 佑介 , 明石 義正 , 久倉 勝治 , 橋本 真治 , 榎本 剛史 |
がん細胞も含め全ての細胞の最外層はGlycocalyxと呼ばれる糖鎖層で覆われている.がん治療をはじめとする多くの細胞標的治療は最外層を構成する糖鎖を標的とする事が効率的だと考えられる.しかし,糖鎖構造の複雑さ,解析手技の制限からがんにおける特異的な糖鎖変化は十分には明らかになっておらず,糖鎖標的治療は実用化されていない.われわれは糖結合タンパクであるレクチンをプローブとして網羅的な糖鎖解析を行い,膵がんに特異的に高発現しているH-type 1/3/4モチーフという3糖構造を明らかにした.これを抗体ではなく,レクチンで標的する新規治療法として,緑膿菌外毒素を融合したレクチンー毒素融合(LDC)を開発した.in vitroではIC50が1.04pg/ml=19.5fmol/Lと極めて強力で,従来の抗体―毒素(Immuno-toxin)における(ng/mlオーダー)と比較し約1,000倍強い殺細胞効果が得られた.さらに,in vivoの皮下腫瘍モデル,腹膜播種モデルにおいても著明な抗腫瘍効果を確認する事ができ,血管内投与でも一切赤血球凝集反応を来さない安全性も確認出来た.レクチンによる糖鎖標的治療は,抗体に依存していた標的抗がん治療に全く新たな第三の選択肢となり得ると考えられた.
キーワード
糖鎖, レクチン, 膵がん, レクチンー毒素融合薬(LDC)
I.はじめに
セントラルドグマに登場するDNA,RNA,タンパク質の3者が生命を担う中心的な役者である事に異論はないが,生体の恒常性維持にはタンパク質の翻訳後修飾によるその機能の活性化,安定化,局在変化が不可欠である.糖鎖修飾=グリコシル化は,タンパク質の翻訳後修飾として最も頻繁に行われるダイナミックな修飾で,おそらくそれはリン酸化よりもはるかに頻繁に行われている1).細胞表面のタンパク質,脂質が糖鎖修飾された結果,がん細胞も含め全ての細胞の最外層はGlycocalyxと呼ばれる糖鎖層で覆われる事になる.Glycocalyxは四つの異なるタイプのタンパク質または脂質骨格上の四つの主要な糖鎖分岐から構成される.すなわち,i)N型糖鎖,O型糖鎖に分類される糖タンパク,ii)膜タンパクのセラミドに糖が結合した糖脂質,iii)プロテオグリカンのSer/Thr残基に結合したグリコサミノグリカン,iv)多数のSer/Thrの繰り返し構造を持つタンパクにO型結合した無数の糖鎖によって修飾された巨大分子であるムチンの四つである(図1)2). Glycocalyxは腫瘍細胞がフィブロネクチン,コラーゲン,ラミニンなどのECM成分との最初の接点であるだけでなく,分子標的抗体や薬剤が最初に出会う最外層に位置する.がん治療をはじめとする多くの細胞標的治療開発が糖鎖層の下に隠れた膜蛋白を標的として行われている事はとても不思議な事で,本来は最外層を構成する糖鎖を標的とする治療のほうがはるかに効率的なのではないか,と考えられる.
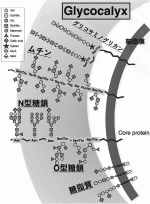
II.糖鎖解析,糖鎖標的治療開発の壁
タンパク質の糖鎖修飾には,Asn残基のアミド末端のN原子に結合するN型糖鎖と,Ser残基,Thr残基の水酸基のO原子に結合するO型糖鎖の2種類がある.糖鎖は核酸,たんぱく質に続く第3の生命鎖として知られるが,前2者が1列にしか並ぶ事ができない単鎖であるのに対し,糖鎖は分岐する点が決定的に異なり,非常に複雑な構造を作り出す.また,糖鎖合成に関わる酵素の多様性もその理解を難しくしている.4種類の核酸を結合させるヌクレオチド結合を担うのは1種類のポリメラーゼであるのに対し,10種類(主には7種類)の糖鎖結合はそれぞれ異なる酵素によって担われている.さらに,6炭糖,5炭糖の炭素分子位置,α,βといった光学異性体ごとにも酵素が異なり,その結果,人においては実に200種類以上の糖関連酵素がその生合成に関わっている3).
核酸研究,タンパク質研究は,意図した配列の核酸(オリゴヌクレオチド)や蛋白(ペプチド)を効率的に有機化学合成できる技術が進歩し,生物学,疾患理解におけるGenome, Transcriptome, Proteomeの理解は飛躍的に進んだ.一方,糖鎖はその複雑な分岐構造に加えて,意図した糖鎖を化学合成で再現する事が難しいという技術的な制限も糖鎖研究の進歩を阻み,Glycome研究の進展は十分とは言えない状況が続いている.
III.がんに特異的な糖鎖変化
がんの発生・進展は生体内で起きる進化論と考えると理解がしやすいが,その観点からは,がんにおける糖鎖変化も意図的に起こるのではなく,偶然そういった糖鎖変化を持った細胞がclonal selectionを受けた結果dominantなpopulationになると考えるのが自然である4).がんにおける糖鎖の変化は,特定の糖鎖の発現消失や過剰発現,不完全または切断された糖鎖の発現増加,糖鎖の付加など,様々な形が観察されている(図2)5).
i)シアリル化
がんに伴う糖鎖の変化として最も良くみられるのは,シアリル化の増加である6).糖タンパクの変化としては,N-型,O-型両方の糖鎖末端の2,6-シアリル化構造の増加,その結果生み出されるシアリルLewisx(SLex)抗原やSLeA抗原の増加,切断されたO-結合型糖鎖のシアリル化(シアリルTn(STn)),そしてポリシアル酸として知られる2,8-結合シアル酸ポリマーの増加などがある.また,糖脂質の変化としては,糖鎖上に一つ以上のシアル酸が結合しているガングリオシドと呼ばれるシアル酸含有スフィンゴ糖脂質が悪性腫瘍と関連していることも明らかにされている6).
ii)フコシル化
フコプロテインは,フコースを糖鎖の一部として含む糖タンパク質の総称であるが,様々ながんはその表面にフコース化した糖鎖を過剰に発現していることが多い4).フコースは非伸長性修飾として,糖鎖の末端や根元のコア構造の横に結合する形で存在し,それ以降の糖鎖の伸長は起こらない.糖鎖の末端にSLexやSLeaなどはフコースを含んでおり,これら特定のルイス血液型抗原の形成に関与する. コアフコース化はN型糖鎖の最も根本のGlcNAcに1,6-fucoseを結合させるフコース転移酵素(FUT8)の活性亢進によって起こるが,異常にフコシル化された血清ハプトグロビンとα-フェトプロテイン(AFP)のL3分画として,肝細胞がんの腫瘍マーカーとして広く用いられている.
iii)O型糖鎖の切断
通常O型糖鎖はSer/Thr残基に一つめの糖鎖としてGalNaAcが結合しており(Mannoseが結合するMan型のO-型糖鎖を別にすれば),そこから様々な単糖が結合して糖鎖としての鎖構造が形成されている.しかし,多くのがんにおいて一つ目のGalNaAcだけが結合した切断されたO型糖鎖がみられる(=Tn抗原).また,そこに二つ目の糖鎖としてGalactoseがついたT抗原,シアル酸がついたSTn抗原なども多くのがんにみられる腫瘍特異的な糖鎖変化である.
iv)N型糖鎖の伸長
腫瘍細胞の糖ペプチドのサイズが大きくなっているという知見は,がんにおける糖鎖研究の初期に見いだされた現象である.これは,N-グリカンのβ1-6分岐が増加したことによってもたらされ,それはN-グリカンのGlcNAc分岐を触媒するMGAT4/5酵素の発現が亢進した結果起きる.
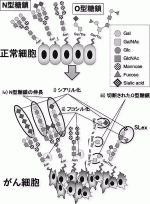
IV.膵がんにおける糖鎖変化
膵がんにおいて最も一般的に知られている糖鎖変化は,O型糖鎖の末端に形成される4糖構造(GlcNAcとGalactoseにフコースとシアル酸が結合)のシアリルLewisA(SLea)であり,CA19-9抗体によって認識される膵がんのバイオマーカーとして臨床診断には不可欠のものである.その他の糖鎖変化として,シアリルLewisX(SLeX),切断されたO型糖鎖,ガレクチン-1/-3,特異的なプロテオグリカン,分岐したフコシル化されたN-グリカンの増加などが挙げられ,これらはすべて,腫瘍細胞の増殖,浸潤,転移,炎症,血管新生など,腫瘍の進行の異なる側面と関連している7).
がん細胞の表面はどの様になっているか?という素朴な疑問に答えるためにはGlycocalyxの理解,糖鎖変化の解析が不可欠だと考え,われわれはヒト膵がん表面の糖鎖状態をレクチンアレイで網羅的に解析した.レクチンは糖鎖に結合する事ができるタンパク質の総称で,様々な糖鎖構造を認識する動物,植物由来のレクチン96種類を載せたレクチンマイクロアレイにより,被験タンパク質がどの様な糖鎖修飾を受けているかを知ることができる8).われわれはヒト臨床膵がんと同様の腺管構造をxenograftで再現できるCapan-1細胞株(これをわれわれはがん幹細胞様の形質を保持している細胞株と認識している)に発現が保たれていてる糖鎖構造を探索した.腺管形成能力の無い他の5種類の膵がん細胞株には発現が失われている糖鎖構造としてHタイプ1/3/4糖鎖(Fuc 1-2Gal 1-3GalNAc)と,それに結合する事ができるレクチン rBC2を同定することが出来た(図3)9).
このrBC2レクチンは,奇しくも先に産総研がヒトiPS/ES細胞に特異的に反応するレクチンとして発見した分子と同一であった10).このrBC2レクチンが認識するHタイプ1/3/4糖鎖の修飾ががん幹細胞とiPS細胞に共通に起きている事はがんstemnessの解明,治療法開発への足がかりになる大きな発見であった.それに加えて,70例のヒト臨床膵臓がんにおけるrBC2レクチンの反応性を確認した所,ほぼ全例で強く反応することも確認でき,rBC2が認識するHタイプ1/3/4糖鎖を膵がんに対する有望な治療ターゲットと確信した9).
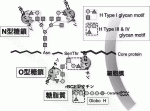
V.がんの糖鎖変化を標的する抗体とレクチン
がんにおける糖鎖変化は腫瘍生物学の研究対象,血清中のバイオマーカーとしての応用は進んでいるが,治療ターゲットとする試みはほとんど例を見ない.糖鎖を標的とする治療開発の利点として,細胞表面上の標的糖鎖の多さがあげられる.抗体は細胞膜上のある特定の膜タンパクのペプチド抗原を認識する為,標的対象の数は非常に限られている.一方,細胞表面上の様々な膜タンパクには共通の糖鎖変化が起きている可能性が高く,実際,AsnとSer/Thr残基に結合した糖鎖だけでも1,000万個以上含まれていると見積もられている11).さらに,glycocalyxを構成する糖脂質,プロテオグリカンなどが標的になる場合,その数は天文学的に多くなる.実際,シアル酸のような末端糖鎖の濃度は100mMにも達する事が知られている11).
糖鎖を標的とするキャリアとしては,Landsteinerによる血液型の概念が糖鎖に対する抗体反応である事を例にとるまでもなく,まず抗体が考えられる.しかし,哺乳類に糖鎖が共通であるので,ある糖鎖構造で動物を免疫しても抗原性が弱く,意図した糖鎖を標的するモノクロ抗体はそう簡単には作成できない12).さらに,既存の抗体薬は動物培養細胞でしか生産出来ない為高額で,患者一人あたりの抗体薬の費用は300~3,000万円に上り医療費を大きく圧迫している.われわれは医療経済的視点からも抗体以外の治療担体の開発に道を開きたいという思いがあり,Hタイプ1/3/4糖鎖の検出に使ったrBC2レクチンプローブを直接膵がん幹細胞を標的する治療担体として使う事を発案した.
VI.レクチンを担体として薬剤を結合し,がん細胞表面糖鎖をターゲットする新規がん治療法への応用
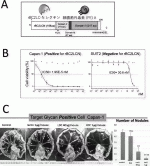
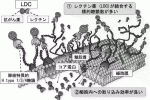
レクチンを治療担体として応用する場合の懸念は,糖鎖―レクチン結合の乖離定数Kd値が10-4〜10-7 Mと,抗原―抗体結合のKd=10-6〜10-9 Mに比べて弱い事であった.われわれはrBC2レクチンに強力な殺細胞効果を持つ緑膿菌の外毒素(PE)を結合させたLectin Drug Conjugate(LDC)を作成した(図4A).
このLDCをCapan-1細胞株にふりかけたin vitro試験におけるIC50は1.04pg/ml=19.5fmol/Lと極めて強力で,これは従来報告されている抗体―毒素(Immuno-toxin)における(ng/mlオーダー)と比較し約1,000倍強い殺細胞効果を示すものであった(図4B).さらに,in vivoの皮下腫瘍モデル,腹膜播種モデルにおいても著明な抗腫瘍効果を確認する事ができた(図4C).この目覚ましい効果は,がん細胞表面上にrBC2レクチンが結合するH-type 1/3/4糖鎖モチーフが非常に多く存在することが,弱い結合能を補って余りあるものである事を示している.
また,レクチンの非特異的な結合により攻撃対象でない細胞への副反応も心配されたが,BC2レクチンへの結合能がほとんど無いSuit-2に対しては,腫瘍抑制効果は全くみられず,H-type 1/3/4糖鎖モチーフをrBC2レクチンで標的する特異性が確認できた.
VII.H type 3糖鎖と結合するrBC2レクチンの生体への安全投与
糖鎖結合タンパク質であるレクチンを治療担体として生体投与する際の最大の懸念は赤血球凝集素反応である.確かに今まで48ファミリーに分類される数千のレクチンが発見されているが,その多くが赤血球凝集活性をもつ事が知られている.一方,近年レクチンに対する知見が蓄積してくると,レクチンによっては血液凝集活性が弱いものもあり,さらには,ヒトの生体の中にも160種以上のレクチンが存在して様々な生理活性に関与している事が明らかになった.われわれのrBC2レクチンはマウス,ヒトの血液に添加しても一切血液凝集を起こさず,静脈内投与も安全に出来る事が確認出来た.
VIII.おわりに
手術を通して患者の命に直に接しているわれわれ外科医が,「なんとかしたい!」という思いから推進する基礎研究には確かな説得力が伴う.外科医が担う役割,仕事の質は時代とともに変遷するが,いつの時代にあってもその根底には「既にヒトが切り開いた道を後追いするのではなく,自ら新たな技術,分野,領域,世界を切り開こう」とする進取の気風が脈々と流れ続けている事にはなんら変わりはない.
レクチンによる糖鎖標的治療は(図5),抗体に依存していた標的抗がん治療に全く新しい第三の選択肢を提示し,新たな一石を投じることが出来たと考えている.
利益相反:なし
文献
1) Munkley J, Elliott DJ: Hallmarks of glycosylation in cancer. Oncotarget, 7: 35478-35489, 2016.
2) Buffone A, Weaver VM: Don’t sugarcoat it:How glycocalyx composition influences cancer progression. J Cell Biol, 219:e201910070, 2020.
3) Vester-Christensen MB, Bennett EP, Clausen H, et al.: Generation of monoclonal antibodies to native active human glycosyltransferases. Methods Mol Biol, 1022: 403-420, 2013.
4) Kang H, Wu Q, Sun A, et al.: Cancer Cell Glycocalyx and Its Significance in Cancer Progression. Int J Mol Sci, 19: 2484, 2018.
5) Stowell SR, Ju T, Cummings RD: Protein glycosylation in cancer. Annu Rev Pathol, 10: 473-510, 2015.
6) Pinho SS, Reis CA: Glycosylation in cancer:mechanisms and clinical implications. Nat Rev Cancer, 15: 540-555, 2015.
7) Munkley J: The glycosylation landscape of pancreatic cancer. Oncol Lett, 17: 2569-2575, 2019.
8) Kuno A, Uchiyama N, Koseki-Kuno S, et al.: Evanescent-field fluorescence-assisted lectin microarray:a new strategy for glycan profiling. Nat Methods, 2: 851-856, 2005.
9) Shimomura O, Oda T, Tateno H, et al.: A Novel Therapeutic Strategy for Pancreatic Cancer:Targeting Cell Surface Glycan Using rBC2LC-N Lectin-Drug Conjugate (LDC). Mol Cancer Ther, 17: 183-195, 2018.
10) Tateno H: Expression and Purification of a Human Pluripotent Stem Cell-Specific Lectin Probe, rBC2LCN. Methods Mol Biol, 2132: 453-461, 2020.
11) Wang Z, Chinoy ZS, Ambre SG, et al.: A general strategy for the chemoenzymatic synthesis of asymmetrically branched N-glycans. Science, 341: 379-383, 2013.
12) Cummings RD, Pierce JM: The challenge and promise of glycomics. Chem Biol, 21: 1-15, 2014.
PDFを閲覧するためには Adobe Reader が必要です。