日外会誌. 123(1): 25-31, 2022
特集
Modern Surgeon-Scientistによる恒常性維持器官の外科研究
4.難治がん術後長期生存を目指した個別化がん免疫療法の開発
|
国立がん研究センター 先端医療開発センター免疫療法開発分野 中面 哲也 |
glypican-3(GPC3)ペプチドワクチン療法は,肝細胞がん,肝芽腫等を対象とした臨床試験において,投与した80%の患者の末梢血中あるいはがん局所に,ペプチド特異的に反応するキラーT細胞(CTL)が検出できることを証明しており,がん細胞が1千億個~1兆個以上の進行がんでも頻度は5%未満と低いが腫瘍縮小効果を示すことがあり,根治的術後のがん細胞が10億個(画像診断で診断可能な1cmのがん)未満の場合は再発を抑える効果も高そうである.GPC3を発現する肝細胞がんの術後の8年生存率はわずか20%程度なのに対して,術後GPC3ペプチドワクチン療法投与群は約60%であり,さらには,再発寛解を繰り返した難治性肝芽腫5人の患児は,GPC3ペプチドワクチン療法のみで全員6年以上無再発(おそらく完全治癒)を達成している.がん遺伝子変異に由来するネオアンチゲンを標的とした個別化がんワクチンも期待されているが,がん共通抗原のレパートリーを増やしていき,ネオアンチゲンも合わせた個別化がん再発予防ワクチン療法を開発することで,難治がんであっても,根治的切除後の個別化ワクチンにより再発しにくくし,再発した場合は同時に開発している個別化T細胞療法でがんを根絶する戦略で,難治がん予後の大幅な改善を実現し,将来的には,難治がんが,リンパ節廓清不要の手術と個別化免疫療法の併用で根治できる時代を目指したい.
キーワード
個別化ワクチン療法, キラーT細胞(CTL), 個別化T細胞療法, 難治がん, 根治
I.はじめに
元外科医の私にModern Surgeon-Scientistの資格があるかはさておき,外科医の心を持ち続け研究を継続している自負はある.私は熊本大学(以下,熊大)第2外科に入局し,外科医は早起きじゃないといけないと,「研修医のための早朝講義」1)の薫陶を受けた.私の恩師小川道雄教授は,一流の教育者であり,超ハードワーカーでもあり,そして,最終講義のタイトル「こころ分子におきてメスを構えるべし」2)にも表されている通り,元祖Modern Surgeon-Scientistとも言うべき外科医であった.私は医学生時代に柳田邦男著「ガン回廊の朝」3)を読んで国立がんセンターに憧れ,小川教授から「外科医はこの社会の最後の貴族である」という言葉とともに送り出され,3年間を国立がんセンター東病院で肝胆膵外科レジデント(竜崇正部長,木下平医長)として過ごした.たくさんの手術を執刀させていただき外科手術の面白さ・奥深さ・難しさや怖さを知るとともに,手術だけでは治らない多くの患者たちに触れたことで基礎研究というものに興味が湧き,江角浩安国立がんセンター研究所支所長の門をたたいた.熊大に戻り,小川教授から,「これからはHLAが大事になる」と「腫瘍免疫と免疫療法」の課題を与えられ,熊大の免疫識別学(西村泰治教授)に派遣され研究生活をスタートした.新規がん抗原のクローニングという研究課題を得てからは,研究が楽しくて仕方ないくらい,のめり込んだ.がん細胞を直接傷害するキラーT細胞(CTL)の研究がしたくて,国内初のペプチドワクチンの臨床試験を実施していた久留米大学免疫学(伊東恭吾教授)に国内留学した.その途中で大学院卒業となり,私の基礎研究を続行したいという希望に対して小川教授から頂いた言葉が「100人の虫垂炎を治すより100万人のがんを治す方がいいに決まっとる.基礎で頑張るのは全然かまわない.でも,頑張ってもダメな時はいつでも戻ってきていいからな.」私が今,Modern Surgeon-Scientistの端くれとしてこの原稿を書けているのはまさに小川教授のおかげである.西村教授から命を受け,小川教授の後輩にあたる中村祐輔教授のラボに1日赴いて,3万遺伝子のcDNAマイクロアレイの膨大なエクセルファイルのデータの中からがん特異抗原glypican-3(GPC3)に出会ったのも何かの縁である.西村教授の下で基礎講座の助手となり,GPC3が肝細胞がん(HCC)の腫瘍マーカー,腫瘍抗原として有用なことを見出し,GPC3ペプチドワクチンを開発した.その臨床試験の実施を国立がんセンター東病院の先生方に相談した結果,江角先生に呼び戻していただき,研究所支所改め臨床開発センター発足に合わせて室長として採用され,ついに外科医を辞めて医師の立場は続行しながら基礎の研究室を主宰することになった.自ら開発したがんワクチンの臨床試験を自ら計画立案し自ら責任医師として患者に説明して同意を取得しワクチンを接種し経過を見るという貴重な経験をさせていただいた.外科医出身の研究者として,臨床研修制度や専門医制度など様々な制度の改革により,基礎研究に触れる外科医が減っているのはとても残念であり,ずっと危機感を覚えている.私の研究室では東病院の外科のレジデントや大学の外科の大学院生も多数受け入れて研究を指導してきているが,がんを治す研究のリーダーになれるのは,まさにModern Surgeon-Scientistしかいないと考えている.本稿を読んでくれた外科医の方々の中から一人でも多くの強い動機と意志を持った優れたModern Surgeon-Scientistが生まれることを期待している.
II.glypican-3(GPC3)ペプチドワクチン療法
われわれが開発したglypican-3(GPC3)ペプチドワクチン療法は,日本人の60%が陽性のHLA-A*24:02用の1種類のペプチド(EYILSLEEL)と,欧米白人のメジャーなHLAで,日本人の40%に応用可能なHLA-A*02:01用の1種類のペプチド(FVGEFFTDV)をそれぞれ,免疫賦活物質(アジュバント)のIFAと混ぜて皮膚に投与するものであり,ペプチドの種類も1種類ずつで効果も限定的と考えられるが,これまで実施してきた肝細胞がん,肝芽腫等を対象とした様々な臨床試験において,投与した80%の患者の末梢血中あるいはがん局所に,ペプチド特異的に反応してサイトカインを産生するキラーT細胞(CTL)が検出できることを証明しており,がん細胞が1千億個~1兆個以上の進行がんでも頻度は5%未満と低いが腫瘍縮小効果を示すことがあり,根治的術後のがん細胞が10億個(画像診断で診断可能な1cmのがん)未満の場合は再発を抑える効果も高そうだという事が示されている4)
~
10).glypican-3を発現する肝細胞がんの術後の8年生存率はわずか20%程度なのに対して,術後glypican-3ペプチドワクチン療法投与群は約60%であり10),さらには,再発寛解を繰り返した難治性肝芽腫5人の患児は,GPC3ペプチドワクチン療法のみで全員6年以上無再発(おそらく完全治癒)を達成している9).
III.ネオアンチゲンの登場
メラノーマや喫煙者の肺がんといった遺伝子変異の多いがんには,免疫チェックポイント阻害抗体による奏効率が高いことがわかっている.大腸がんには多くの場合無効であるが,高頻度マイクロサテライト不安定性(MSI-High)の患者では奏効することが知られている.遺伝子変異によりアミノ酸変異が生じ,その変異ペプチド(ネオアンチゲンという)ががん細胞表面のHLAに提示されると,T細胞はそれを非自己抗原と認識して攻撃を加え,がん細胞を排除する方向に働く.「遺伝子変異ががん拒絶抗原になる」という考えは,1990年代後半に提唱されたが,多くは患者個々の遺伝子変異(ドライバー変異に対してパッセンジャー変異と言われる)に基づくものであり,個別化医療としてしか役立てないことから当時はあまり見向きもされなかった.2000年代初頭には,RasやTP53といった,がん細胞の生存や増殖に必須の遺伝子(いわゆるドライバー遺伝子)の変異に対するペプチドワクチン療法が行われた.パッセンジャー変異は,当時の技術では同定が困難であったが,近年の次世代シークエンス技術の進歩により全ゲノムで遺伝子変異の同定が可能となり,パッセンジャー変異を含む「ネオアンチゲンがんワクチン」の開発が一気に加速した.
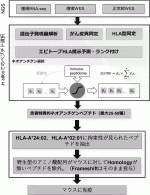
われわれも企業と共同で,患者個々でがん組織のオミクス解析から発現する遺伝子変異を抽出し,それらに対するネオアンチゲン予測を可能とするパイプラインを開発した(図1).国立がん研究センター東病院で根治的切除術を受けた肝細胞がんおよび転移性肝がん患者40例を対象に,腫瘍,正常組織を収集し,組織より核酸を抽出し全エクソン解析およびRNA-シークエンス解析により,エクソン部に蓄積した体細胞変異とその頻度,ならびに変異アレルの転写発現を確認した.HLAタイプを決定し,HLA-A*24:02およびHLA-A*02:01に結合が予測されるネオアンチゲンぺプチドを,アミノ酸配列をもとに独自に構築した回帰モデルにより予測した.予測したネオアンチゲンペプチドをヒトHLA発現マウスに免疫した結果,正常配列には反応がみられず,ネオアンチゲン特異的な免疫応答が認められた.HLA-A*24:02およびHLA-A*02:01発現マウスにおける陽性率は約50%程度で,同程度であった.免疫したマウスから濃縮したCTLは,ペプチドをパルスしたがん細胞に対し,強い細胞傷害活性を示した.ネオアンチゲンは,免疫原性,がん特異性において極めて優れていると言えるが,患者個別にワクチンを精製する必要があり,開発や臨床試験の実施においては,コスト面,規制面でまだまだクリアしないといけないハードルがあるのも確かである11)
~
15).
IV.術後再発予防個別化がんワクチンの開発
ネオアンチゲンの登場により,GPC3のような抗原は共通がん抗原と呼ばれるようになり,これまでの共通がん抗原のペプチドワクチンのPhase 3の試験が失敗していることもあって,がんワクチンの開発においてはネオアンチゲンのみに注目が集まっているところではあるが,GPC3ペプチドワクチンの臨床試験が示してくれた可能性から,われわれは共通がん抗原がダメだとは思っていない.むしろ,開発コストの面からは,個別に抗原の精製が必要になってしまうネオアンチゲンよりも,オフザシェルフで用意できる,共通がん抗原でカバーしてしまう方が圧倒的に優れていることから,GPC3と同等のがん特異性を示す多くのがん特異的抗原に着目し,それらの全長配列の中からHLA-A*24:02あるいはHLA-A*02:01に結合しうるペプチドを多数合成し,各トランスジェニックマウスを用いたin vivoワクチン実験によって,これまで臨床試験に使用してきた(EYILSLEEL),(FVGEFFTDV)の2種類のペプチドよりも強烈にペプチド特異的CTLを誘導しうる,ワクチンとしてより優れた免疫原性のあるペプチドを約100種類同定することに成功した(図2).HLA-A*24:02およびHLA-A*02:01の2種類のHLAで,日本人の85%,および世界の人口の50%をカバーできるが,われわれは,GPC3のような多くの患者に使用できる共通がん抗原をベースに,患者個別のネオアンチゲンも組み合わせていくことで,より術後再発予防効果の高い個別化がんワクチンの開発を目指している.われわれは,あらゆるがんの術後再発予防ワクチンの開発を目指しており,並行して,われわれが所有する共通がん抗原でどれくらいのがん患者をカバーできるか,頭頚部がん,乳がん,食道がん,肺がん,胃がん,肝がん,胆道がん,膵がん,大腸がん,腎がん,膀胱がん,前立腺がん,卵巣がん,子宮がんなどにおける,これら共通がん抗原の発現を免疫組織化学的解析により明らかにする研究を実施中である.また,一連の各トランスジェニックマウスを用いたin vivoワクチン実験によって,これまでの臨床試験でアジュバントとして使用してきたIFAよりも,Toll-Like Receptor 3(TLR3)やTLR9を活性化するアジュバントの方が,免疫賦活効果も高く,ペプチド特異的CTLの誘導能に優れていることを実証している.
COVID-19ワクチンとしてmRNAワクチンが大ブレークしたが,がんワクチンとしても,mRNAワクチンはペプチドワクチンと並んで開発されてきた歴史がある.われわれの共通がん抗原は,当然,mRNAワクチンとしても開発可能である.今回日本はCOVID-19ワクチンの開発において惨敗を喫した.欧米が開発したワクチンに頼らざるを得ない悲惨な状況である.せめてがんワクチンだけはこの状況を打破するべきと,さらに研究開発を加速させているところである.

V.個別化T細胞療法の開発
2000年以降,わが国は再生医療研究を重点的に推進した結果,細胞モダリティ開発に関する論文数は米中に次ぐ世界第3位であるが, CAR/TCR-T細胞療法の開発においては,米中欧に大きく水をあけられている.しかし,固形がんに対して著効を示すほどのT細胞療法は未だ開発されておらず,オリジナルのCAR/TCR-T細胞療法の開発に加え,T細胞そのものの遺伝子改変や,抗腫瘍効果を増強させるオリジナルの手法を開発できれば,まだまだ米中欧を逆転することも可能であり,多くの進行がんの患者を救える可能性がある.われわれは,GPC3を標的としたCAR/TCR-T細胞療法の開発に加え,切除したがん組織中の腫瘍浸潤リンパ球(TIL)の中からマーカーによって自己がん細胞反応性CTLを取得するところまでは成功しており,それらのTCR配列を同定する技術もあり,個別化TCR-T細胞療法の開発も実施している.がんワクチンでは再発防止が難しそうな場合は,開発する新規CAR/TCR-T細胞療法ならびに個別化T細胞療法によるがん細胞根絶のプランも用意できる.
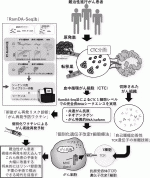
VI.血中循環がん細胞(CTC)によるがんの再発リスク診断法の開発
次世代シーケンサー技術やバイオインフォマティクスの発達により,ネオアンチゲンの同定が可能になったように,血中循環腫瘍DNAによって再発リスク診断や個別化分子標的治療の可能性も見えてきた.同時に,血中循環がん細胞(CTC)が真のがん細胞であると証明できる時代になったとも言え,CTCによるがんの再発リスク診断にも期待している.理研二階堂らが開発した1細胞完全長トータルRNAシーケンス法(RamDA-seq法)は,まさに,CTCが真のがん細胞であることを証明し,かつ,その配列からネオアンチゲンや共通がん抗原由来ペプチドの予測を可能にする技術であり,その活用により,CTCによるがんの再発リスク診断と個別化がん再発予防ワクチンの開発が可能になったと考えている.
VII.おわりに
この文明や医療技術が進歩した現代でも,がんと診断された患者の約4割が命を落としている.難治がん根治的切除後に,CTCでがんの再発リスク診断を行いながら,個別化がん再発予防ペプチドワクチンによって術後のがんの再発を抑え込み,再発した場合は個別化T細胞療法でがんを根絶することで,難治がん予後の大幅な改善を実現し,Modern Surgeon-Scientistの端くれとしては,将来的には,難治がんが,リンパ節廓清不要の手術と個別化免疫療法の併用で根治できる時代を目指したい(図3).多くの若き外科医のみなさんのこの研究分野への参画を期待している.
利益相反
研究費:ブライトパス・バイオ株式会社,NA Vaccine Institute CO., LTD,株式会社ダイセル,サイアス株式会社,小野薬品工業株式会社,タカラバイオ株式会社,NapaJen Pharma株式会社,株式会社メディネット
文献
1) 小川 道雄:外科学臨床講義V(別巻2)研修医のための早朝講義.へるす出版,東京,2004.
2) 小川 道雄:外科学臨床講義IV 最終講義 こころ分子におきてメスを構えるべし.へるす出版,東京,2003.
3) 柳田 邦男:ガン回廊の朝(上)(下).講談社文庫,東京,1981.
4) Sawada Y, Yoshikawa T, Nobuoka D, et al.: Phase I trial of glypican-3-derived peptide vaccine for advanced hepatocellular carcinoma:immunological evidence and potential for improving overall survival. Clin Cancer Res, 18: 3686-3696, 2012.
5) Sawada Y, Yoshikawa T, Fujii S, et al.: Remarkable tumor lysis in a hepatocellular carcinoma patient immediately following glypican-3-derived peptide vaccination:an autopsy case. Hum Vaccin Immunother, 9: 1228-1233, 2013.
6) Suzuki S, Shibata K, Kikkawa F, et al.: Significant clinical response of progressive recurrent ovarian clear cell carcinoma to glypican-3-derived peptide vaccine therapy:two case reports. Hum Vaccin Immunother, 10: 338-343, 2014.
7) Sawada Y, Yoshikawa T, Ofuji K, et al.: Phase II study of the GPC3-derived peptide vaccine as an adjuvant therapy for hepatocellular carcinoma patients. OncoImmunology, 5:e1129483, 2016.
8) 中面 哲也: がん免疫療法-がん完治に向けての新たな治療法の探索-Ⅱ.各論 がんペプチドワクチン Glypican-3抗原を標的にしたがんペプチドワクチン.日本臨牀,75:257-262,2017.
9) Tsuchiya N, Hosono A, Yoshikawa T, et al.: Phase I study of glypican-3-derived peptide vaccine therapy for patients with refractory pediatric solid tumors. OncoImmunology, 7:e1377872, 2017.
10) Taniguchi M, Mizuno S, Yoshikawa T, et al.: Peptide vaccine as an adjuvant therapy for glypican-3 positive hepatocellular carcinoma induces peptide specific CTLs and improves long prognosis. Cancer Sci, 111: 2747-2759, 2020.
11) Shimizu Y, Suzuki T, Yoshikawa T, et al.: Cancer Immunotherapy Targeted Glypican-3 or Neoantigens. Cancer Sci, 109: 531-541, 2018.
12) 鈴木 利宙,中面 哲也: 「特集」躍進するがん免疫療法 ネオアンチゲンとそれを標的としたがんワクチン療法.ファルマシア,53:15-19,2017.
13) 中面 哲也:がんワクチン-共通抗原からネオアンチゲンへ,そして将来は?第2章腫瘍免疫応答の制御法.実験医学増刊号,37(15):126-132,2019.
14) 鈴木 利宙,中面 哲也:特集「がん免疫療法におけるバイオマーカーと新規治療アプローチ」5.がん免疫における新規治療アプローチ,3)ネオ抗原を標的としたワクチン療法.腫瘍内科,26: 79-87,2020.
15) 鈴木 利宙,中面 哲也:特集「がん治療における個別化医療の潮流」,がんペプチドワクチンの個別化免疫療法への展開.Precis Med,3: 10(1290)-14(1294),2020.
PDFを閲覧するためには Adobe Reader が必要です。