日外会誌. 123(1): 18-24, 2022
特集
Modern Surgeon-Scientistによる恒常性維持器官の外科研究
3.膵島移植と再生医療の融合を促進する技術の開発
|
東北大学医学系研究科 移植再生医学分野 後藤 昌史 |
移植医療と再生医療は密接に関連しており,現行の移植医療が抱える様々な課題を,今後再生医療が効果的に解消していくことが期待されている.こういった流れにおいて,細胞移植治療で得られる知見は極めて有用であり,細胞移植は移植医療と再生医療を橋渡しする重要な意義を有していると考えられる.膵島移植はそのような細胞移植治療の典型例であり,血糖コントロールに苦しむ重症1型糖尿病患者にとり,まさに理想的な患者に優しい治療法である.しかし,今後より多くの重症糖尿病患者へこの治療を提供していくには,他の細胞移植と同じように再生医療との融合が必須である.膵島移植と再生医療の効果的融合を実現するためには,“皮下膵島移植法の改良”,“免疫隔離細胞デバイスの開発”,そしてより実用性の高いアプローチとして“膵島移植や再生医療の実施に好都合な免疫抑制剤の開発”の各項目において,技術革新を引き起こすことが重要であると思われる.
キーワード
膵島移植, 1型糖尿病, 再生医療, 皮下移植, 免疫隔離細胞デバイス
I.はじめに
この度,日本外科学会機関紙の特集“Modern Surgeon-Scientistによる恒常性維持器官の外科研究”への執筆という貴重な機会を頂き,日本外科学会理事長である森正樹先生,日本外科学会邦文誌編集委員長である小澤壮治先生,同編集委員である大段秀樹先生をはじめとする関係者の方々へ厚く御礼申し上げます.
医学の進歩における外科研究の重要性は,周知の通りであるが,膵島移植の分野においても,外科研究はまさに時代の節目を切り拓く極めて意義深い役割を担ってきた.膵島移植は現在でも外科医のみならず,むしろ糖尿病内科医や放射線科医などが積極的に関与し推進していく姿が一般的となっているが,新規膵島分離法の開発,同種膵島移植の臨床応用,新規膵島移植プロトコールの開発(エドモントンプロトコール),自家膵島移植の臨床応用,生体膵島移植の臨床応用といった革新的業績に基づく分野の進展は,ほぼ例外なくSurgeon-Scientistによってもたらされたことは特記に値する.
本稿においては,筆者が専門にしている膵島移植をより一般的な医療として普及していくための鍵になると思われる,“膵島移植と再生医療の融合を促進する技術”について,外科的な観点に重きを置きながら,筆者らの最新の知見も組み込み,述べていく.
II.移植医療と再生医療
2020年4月に,ようやくわが国においても脳死ドナーおよび心停止ドナーからの同種膵島移植が保険収載された.これにより,膵島移植が重症糖尿病に対する一つの治療オプションとして加わることとなり,移植医療が抱える大きな課題である高侵襲性を解消する目処がついた.
しかし,今後より多くの重症糖尿病患者へこの新たな治療オプションを提示していくためには,移植医療の残された課題である,ドナー不足と免疫抑制剤による副作用に対する有効な対策を打ち出していくことが,極めて重要である.再生医療との融合は,膵島移植にとって数ある対策の中でも,現状では最も効果的な戦略の一つと考えられている.
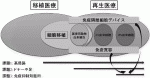
元来,移植医療と再生医療は密接に関連しており,現行の移植医療が抱える様々な課題を,今後再生医療が効果的に解消していくことが期待されている.移植医療と再生医療を融合していくにあたり,膵島移植のような細胞移植治療で得られる種々の知見は極めて有用であり,言い換えれば,細胞移植は移植医療と再生医療を橋渡しする重要な意義を有していると考えられる(図1).現在の移植医療は,前述したように,高侵襲,ドナー不足,免疫抑制剤による副作用といった深刻な課題を有しているが,免疫隔離細胞デバイスや免疫寛容導入といった革新的技術の活用で再生医療と効果的に融合することにより,課題を克服できるのではないかと期待されている.
III.皮下膵島移植法の改良
現行の膵島移植においては,経皮経門脈経路で肝臓内に移植する方法が世界標準であるが,いくつかの問題点が存在する.まず,移植膵島が門脈血に接触すると,激しい原始免疫反応を惹起し,多くの移植膵島が移植後数時間で破壊されることが知られている1)
2).また,出血・門脈塞栓・門脈圧亢進症といった合併症の危険性も指摘されている3).さらに胚性幹細胞(Embryonic Stem (ES)細胞)や人工多能性幹細胞(induced Pluripotent Stem (iPS)細胞)由来のインスリン産生細胞を用いる再生医療との融合においては,万一感染や腫瘍化などが発生した場合,肝臓内に移植された膵島を摘出することは技術的に極めて困難である.以上の理由から,経門脈移植は膵島移植にとって最適な移植方法とは言い難く,特に再生医療との融合においては,新たな移植部位の確立が必須となっている.
数ある移植部位の候補の中でも,特に皮下組織への移植は低侵襲であり,複数回の膵島移植を安全に実施することが可能であり,また必要時に移植膵島の摘出を容易に行えるなど,様々な利点を有しているため,最適な移植部位の一つとみなされている.しかしながら,皮下は血管に乏しく,移植膵島に十分な酸素や栄養を供給することができないため,何も前処置を施さない皮下への膵島移植は,標準法である経門脈移植と比べて多量の膵島が必要となることが報告されている4)
5).そのため,移植膵島の生着率向上を目的とし,皮下における血管新生を促進させる様々な方法が探求されてきた.
Kawakamiらは,移植部位である皮下組織にbasic fibroblast growth factor (bFGF)を1週間前留置することにより,皮下の血管新生を効果的に促進し,皮下膵島移植の成績が向上することを,糖尿病ラットモデルを使用し実証した6).
また,Pepperらは皮下の移植予定部位に,一時的にナイロンカテーテルを埋め込むことで生じる適度な異物反応を利用して,糖尿病マウスの血糖値が一定期間正常化することを報告した7).
著者らもbFGF前留置の至適濃度などに関し種々の検証を行ってきたが,bFGFは一定の腫瘍化リスクや,出血および炎症惹起性を伴うため,実用化に際しては慎重とならざるを得ない.そこで筆者らは,強い細胞接着効果を有し,血管誘導作用を有するRGD基を豊富に含有する新規リコンビナントタイプコラーゲン素材(リコンビナントペプチド:RCP)に着目した.RCPデバイスは,10日間の前留置期間では効果が不十分であったが,移植部位となる皮下組織に4週間前留置することにより,皮下膵島移植の治癒率を,現行の標準移植法である経門脈移植と同等まで高めることが可能であった5).RCPは既にFDAの承認を取得したGMPグレードの医療機器素材であり,今後の実用化が期待される.
IV.免疫隔離細胞デバイスの開発
膵島移植と再生医療の融合によりもたらされる最大のメリットとして,ドナー不足の解消が挙げられる.iPS細胞が本来の期待通り,自己由来のインスリン産生細胞ソースとして活用できれば申し分ないと思われるが,現実的には医療コストの観点や,1型糖尿病が自己免疫性疾患であるという性質を鑑みると,iPS細胞を活用する場合も,他家由来の細胞となる可能性が高いと考えられる.したがって,ES細胞,iPS細胞,医療用動物由来膵島のいずれをドナー膵島として活用する場合においても,免疫抑制剤の使用は必須と考えられ,特に医療用動物由来膵島の使用時には,異種移植となるため,通常の同種膵島移植の場合に比し,さらに多量の免疫抑制剤服用が必要となることが予想される.
免疫抑制剤は,レシピエントに時には死に至るような重篤な副作用を引き起こすが,さらに近年ではレシピエントのみならず,移植膵島にも有害な作用を発揮することが報告されている8).したがって,“免疫抑制剤の副作用回避”は,現行の同種膵島移植においては勿論,再生医療との融合が実現した際にも,最優先となる解決すべき課題と考えられる.
この課題を解決する有力な方法の一つとして,免疫隔離細胞デバイスの開発が挙げられる.膵島移植と再生医療との融合において,特にES細胞由来インスリン産生細胞やiPS細胞由来インスリン産生細胞をドナーソースとして使用する場合には,万一の腫瘍化などの不具合が発生した際に,容易に摘出が可能であり,レシピエントの体内組織との完全隔離が可能となる免疫隔離細胞デバイスを構築する意義は極めて大きく,安全性確保というレギュレーションの観点からも,再生医療との融合推進へ貢献すると考えられる(図2).
免疫隔離細胞デバイスは,大きくマクロカプセル型とマイクロカプセル型に分類される.マクロカプセル型は一般に頑強であり,体内からの取り出しが容易であるため,新鮮な細胞を包埋した細胞デバイスとの入れ替え移植が可能という利点を有しているが,一つの大きなデバイス内に大量の細胞を含有することになるため,デバイスの中心部に配置された細胞への酸素透過性は不良であり,壊死に陥り易いという欠点を抱えている.一方,マイクロカプセル型は,一つの細胞デバイス内に含有する細胞数は通常数個程度であり,デバイスの隔壁も薄い構造となっているため,包埋された細胞は中心部においても酸素透過性が良好であり,壊死に陥り難いという利点を有しているが,一般に構造が脆弱であり,周囲組織と癒着し易い材質が多用されるため,体内からの取り出しは困難であり,また免疫学的感作を惹起し易いという欠点を抱えている.
近年の技術革新により,種々の材質を用いた免疫隔離細胞デバイスが開発されており,一部の細胞デバイスは既に臨床応用に至っている.マイクロカプセル型細胞デバイスとしては,Vegasらが,アルギン酸で構成される免疫隔離細胞デバイスでES細胞由来ヒトインスリン産生細胞を包埋し,糖尿病マウスへ腹腔内移植することにより,最長170日生着することを報告している9).また,ブタ膵島をAlginate-poly-L-ornithine-Alginateで構成されるマイクロカプセル型免疫隔離細胞デバイスで包埋し,14人の1型糖尿病患者へ腹腔内移植する臨床試験がニュージーランドで実施され,大多数の症例で無自覚低血糖発作の減少が報告されている10).
マクロカプセル型デバイスとしては,Dufraneらが,ブタ膵島をアルギン酸カルシウムゲルで包埋し,糖尿病サルへ皮下移植することにより,6カ月間血糖値の正常化が可能であったことを報告している11).また,Harringtonらは,ヒアルロン酸/コラーゲンハイドロゲルで構成されるマクロカプセル型免疫隔離細胞デバイスの大網内移植が,ラット同種糖尿病モデルにおいて,1年以上に渡り有効であったことを報告している12).
著者らも複数企業と連携し,免疫隔離細胞デバイスの実用化を目指している.著者らは前述したように,膵島と再生医療の融合においては,万一の腫瘍発生時にも摘出が容易であり,追加移植も可能である皮下移植が必須になると考え,皮下移植に対応できる頑強なマクロカプセル型免疫隔離細胞デバイスの開発に取り組んでいる.細胞デバイスを構築する材質としては,生体適合性に優れ,重合度と濃度のコントロールにより,物質透過性の制御が容易である変性ポリビニルアルコールに着目している.ポリビニルアルコールを結晶化する場合,凍結による水素結合が頻用されるが,この手法を細胞デバイスへ用いると,包埋細胞が凍結障害を被るため,viabilityの保持が大きな課題であった.そこで著者らは発想を転換し,水素結合ではなく,化学架橋による共有結合に基づくポリビニルアルコールのゾル化手法の確立に取り組み,包埋細胞が凍結障害を被らずviabilityを保持できる細胞デバイスを構築することに成功した.この細胞デバイスは,細胞を詰め込む袋状タイプではないため,デバイス内に包埋細胞をモノレイヤー状に配置することが容易であり,また包埋細胞の全周性コーティングが可能であり,細胞注入口からの免疫細胞の混入といった既存デバイスの課題を完全に払拭できる点が最大の特色である.著者らは,独自に考案した補体透過阻止試験により,変性ポリビニルアルコールの重合度および濃度の至適化を行い,これまでに小動物異種膵島移植モデルにおいて,免疫抑制剤非使用下で1年以上に渡り安定的に糖尿病を治癒できることを確認し,現在AMEDのサポート下に,実用化を目指し開発を推進中である.

V.膵島移植や再生医療の実施に好都合な免疫抑制剤の開発
これまで述べたように,免疫抑制剤の完全回避を実現するには,免疫隔離細胞デバイスの開発,あるいは免疫寛容の誘導が必須となるが,免疫抑制剤の副作用を軽減するためのより実用的な手法として,副作用が多いことで知られる現行の標準免疫抑制剤であるカルシニューリン阻害剤に依存しない,新たな機序の免疫抑制剤を見出すことも有効な対処法と考えられる.
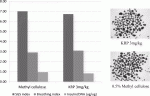
著者らは,リンパ球の動きを封じ込めることにより免疫調節機能を発揮する,スフィンゴシン-1-リン酸の機能的アンタゴニストであるKRP-203に着目し,現在検証を実施している.これまでの検証により,新規免疫抑制剤であるKRP-203は,カルシニューリン阻害剤と全く異なり,移植膵島の耐糖能障害を惹起せず(図3),また新生血管構築作用も阻害しないことが明らかとなっている(図4)13).KRP-203は,同種異系モデルにおける免疫拒絶反応も効果的に制御することが判明しているため13),これまでにない膵島移植に適した免疫抑制剤として,再生医療との融合の際にも大いに役立つことが期待される.

VI.おわりに
膵島移植は,血糖コントロールに苦しむ重症1型糖尿病患者にとり,理想的な患者に優しい治療法である.しかし,今後より多くの重症糖尿病患者へこの治療を提供していくには,再生医療との融合が必須である.膵島移植と再生医療の効果的融合を実現するためには,“皮下膵島移植法の改良”,“免疫隔離細胞デバイスの開発”,そしてより実用性の高いアプローチとして“膵島移植や再生医療の実施に好都合な免疫抑制剤の開発”の各項目において,技術革新を引き起こすことが重要と思われる.
謝 辞
本稿における著者らの研究に関しては,国立研究開発法人日本医療研究開発機構(AMED)の再生医療実現拠点ネットワークプログラム“技術開発個別課題”,および日本学術振興会科学研究費基盤研究A(18H04056)の助成により実施したものである.
利益相反
研究費:信越化学工業株式会社,日本酢ビ・ポバール株式会社
文献
1) Bennet W , Sundberg B , Lundgren T , et al.: Damage to porcine islets of Langerhans after exposure to human blood in vitro, or after intraportal transplantation to cynomologus monkeys: protective effects of sCR1 and heparin. Transplantation, 69(5): 711-719, 2000.
2) Goto M , Johansson H , Maeda A , et al.: Low molecular weight dextran sulfate prevents the instant blood-mediated inflammatory reaction induced by adult porcine islets. Transplantation, 77(5): 741-747, 2004.
3) Yin D , Ding JW , Shen J , et al.: Liver ischemia contributes to early islet failure following intraportal transplantation: benefits of liver ischemic-preconditioning. Am J Transplant, 6(1): 60-68, 2006.
4) Juang JH , Bonner-Weir S , Ogawa Y , et al.: Outcome of subcutaneous islet transplantation improved by polymer device. Transplantation, 61(11): 1557-1561, 1996.
5) Uematsu SS , Inagaki A , Nakamura Y , et al.: The Optimization of the Prevascularization Procedures for Improving Subcutaneous Islet Engraftment. Transplantation, 102(3): 387-395, 2018.
6) Kawakami Y , Iwata H , Gu Y , et al.: Modified subcutaneous tissue with neovascularization is useful as the site for pancreatic islet transplantation. Cell Transplant, 9(5): 729-732, 2000.
7) Pepper AR , Gala-Lopez B , Pawlick R , et al.: A prevascularized subcutaneous device-less site for islet and cellular transplantation. Nat Biotechnol, 33(5): 518-523, 2015.
8) Nishimura R , Nishioka S , Fujisawa I , et al.: Tacrolimus inhibits the revascularization of isolated pancreatic islets. PLoS One, 8(4):e56799, 2013.
9) Vegas AJ , Veiseh O , Gurtler M , et al.: Long-term glycemic control using polymer-encapsulated human stem cell-derived beta cells in immune-competent mice. Nat Med, 22(3): 306-311, 2016.
10) Matsumoto S , Tan P , Baker J , et al.: Clinical porcine islet xenotransplantation under comprehensive regulation. Transplant Proc, 46(6): 1992-1995, 2014.
11) Dufrane D , Goebbels RM , Gianello P : Alginate macroencapsulation of pig islets allows correction of streptozotocin-induced diabetes in primates up to 6 months without immunosuppression. Transplantation, 90(10): 1054-1062, 2010.
12) Harrington S , Williams J , Rawal S , et al. : Hyaluronic Acid/Collagen Hydrogel as an Alternative to Alginate for Long-Term Immunoprotected Islet Transplantation. Tissue Eng Part A, 23(19-20): 1088-1099, 2017.
13) Fathi I , Nishimura R, Imura T , et al.: KRP-203 is a Desirable Immunomodulator for Islet Allotransplantation. Transplantation, July 1: 2021 (Online ahead of print).
PDFを閲覧するためには Adobe Reader が必要です。