日外会誌. 123(1): 12-17, 2022
特集
Modern Surgeon-Scientistによる恒常性維持器官の外科研究
2.多能性幹細胞を用いた細胞・組織移植における免疫制御法の開発と移植医療における意味
|
北海道大学 遺伝子病制御研究所免疫生物分野 清野 研一郎 |
多能性幹細胞の樹立を受け,それらをソースにした細胞・組織の移植医療(広義の再生医療)の確立が期待されている.この場合でも,ドナーとレシピエントに遺伝学的な差異があれば(すなわちallogeneicであれば)免疫拒絶反応が生じる.われわれはこのような場合に起こる免疫反応とその制御法についてこれまで研究を進め,その特徴と抑制法について明らかにして来た.多能性幹細胞を用いた移植医療の発展にはこのような免疫学的アプローチによる研究は依然重要であると考えている.一方,真に重要なことは多能性幹細胞から分化誘導した機能的細胞を移植することによって臓器移植と同程度に症状や予後の改善が得られる方法を確立することである.さらに次世代のsurgeon-scientistが取り組むべき課題の一つは狭義の再生医療,すなわち機能を失いつつある臓器や組織を移植の技術のみに頼ることなく蘇らせる医学とテクノロジーを開発していくことであろう.
キーワード
Transplantation, ES cells, iPS cells, regenerative medicine, immune regulation
I.はじめに
20世紀,外科学は一つの大きなパラダイムシフトを迎えた.それまで悪い病巣を修復する(repair)あるいは切除する(resection)ことが主体であった外科学であるが,機能を失った部分(臓器)を良いものに置換する(replacement),いわゆる移植医療が現実のものとなったのである.移植医療は成功を収め,それまで治すことのできなかった多くの患者を救う結果となった1).しかし一方,移植医療の発展はドナー不足と言う重大な問題を浮き彫りにし,またその侵襲性の高さからより低侵襲な別の方法が探られるようになった.そのような中,20世紀後半の発生生物学的な知見がこれらの問題を解決する糸口になると期待された.それはヒトES細胞という多能性幹細胞の樹立であり2),それから移植用の細胞を作製し移植すれば生体由来の臓器あるいは組織の移植に代わることが期待されたのである.さらに21世紀に入りヒトiPS細胞の樹立が報告されるに至り3),このmovementは非常に大きな強いうねりとなった.実際,これらの多能性幹細胞から特定の機能を持った細胞を分化誘導する研究が数多く行われ,その移植に関する知見も積み上げられ一部は臨床応用されている4).しかしES細胞はもちろんiPS細胞においても,他人由来の細胞を用いた場合には免疫学的な拒絶反応が問題となる.われわれは多能性幹細胞を用いた細胞・組織移植の時代にも免疫制御の重要性は続くと考えこれまで研究を継続して来た.本稿では主にiPS細胞を用いた移植における免疫制御法に関するわれわれの研究内容を紹介したい.
II.MHCホモドナーからヘテロレシピエントへの組織移植実験モデルの確立
iPS細胞を用いた移植を行う場合,患者自身の細胞からiPS細胞を作製することが理想的である.しかし,iPS細胞の樹立にかかる時間的また経済的問題から,事前にMHC(HLA)がホモであることがわかっているドナーの細胞から数種類のiPS細胞を樹立しストックする事業が京都大学を中心に進められている5).これらのiPS細胞から誘導した機能細胞をMHCヘテロのレシピエントに移植した場合,免疫拒絶反応は低減することが期待される.だが,一致するMHCは一部であり,また数多くのマイナー抗原が不一致となることから何らかの免疫反応が発生することが予想される.このような組み合わせでの免疫反応を調べるための良い実験モデルが存在しなかったことから,われわれはマウスを用いてまずそれを樹立した(図1)6).iPS細胞を用いた移植では細胞もしくは組織が移植されるケースがほとんどであることが予想される.そこで本実験モデルでは移植片として皮膚を選択した.
まずレシピエントとしてはMHCヘテロであることが必要であることから,MHCハプロタイプ(b/b)の129X1/Svマウスと(k/k)であるC3H/Heを交配したC3129F1マウス(k/b)を用いた.ドナーとしては図1に示すように自己であるC3129F1(k/b),MHC不一致であるBALB/c(d/d),MHCは一致しているがマイナー抗原が不一致のCBA/N(k/k)およびC57BL/6(b/b)を選択した.免疫抑制剤を投与せずに移植した場合,自己であるC3129F1(k/b)の皮膚は100%生着したが,BALB/c(d/d)の皮膚は16日以内に全例拒絶された.ではマイナー抗原のみ不一致の場合はどうであるかというと,CBA/N(k/k)の皮膚は27日以内に,C57BL/6(b/b)の皮膚はBALB/c(d/d)と同様早期に拒絶された(図2).移植片の病理学的検査を行ったところ,拒絶反応が起きた部分には非常に多くのT細胞とマクロファージが浸潤していた6).この実験から,MHCが一致しておりマイナー抗原のみが不一致の場合でも,組み合わせによっては非常に早く拒絶反応が起きることが判明した.
次にマイナー抗原不一致の場合のT細胞の応答性を試験管内で検討した.C3129F1マウスの脾細胞(B細胞除去)を各ドナーの脾細胞(放射線照射済み)と共培養しC3129F1マウス脾細胞内のT細胞増殖を調べると,図3に示すように各グループとも十分な増殖がみられた.興味深いことに,これらの実験を精製したT細胞と抗原提示細胞(樹状細胞)で行うとマイナー抗原不一致では増殖がみられなかった6).すなわち,MHC一致マイナー抗原不一致の場合,T細胞の活性化はindirect pathwayで誘導されていることが判明した.
次に移植後のアロ抗原に対する抗体産生を検討した.皮膚移植後のレシピエントの末梢血から血清を調製し,各ドナー由来の細胞に対する反応性を検討した.すると図4に示すようにMHC不一致であるBALB/cに対する抗体の存在は検出されたが,マイナー抗原のみ不一致の場合は抗体産生が認められなかった.すなわち,マイナー抗原のみ不一致の移植では抗体関連型拒絶が起きる可能性は低いことが示唆された.


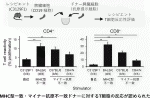
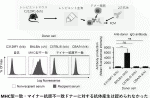
III.MHCホモドナーからヘテロレシピエントへの組織移植における免疫抑制療法
これらの状況における移植拒絶反応はどのようにして治療したら良いのか.われわれは上記皮膚移植の実験で,通常臓器移植で使用されるタクロリムスまたはラパマイシンを連日投与した.投与量は通常ヒトで使用される量の10倍以上を投与した.しかし両薬剤ともCBA/Nドナーの皮膚移植片の生着を一部延長させたが,BALB/cおよびC57BL/6の移植片に至ってはほとんど延長効果を認めなかった(図5).よって,MHC一致マイナー抗原不一致の移植における拒絶反応は,免疫抑制剤単剤ではコントロールが困難であることが示唆された.
そこでわれわれは,本皮膚移植モデルを用いてMHCホモドナーからヘテロレシピエントへの移植拒絶反応を制御する免疫抑制療法についてさらに検討を行った.詳細な内容は現在論文投稿中であるが,結果をまとめると次のようになる.
・臓器移植で通常用いられる3剤併用療法(カルシニュリン阻害剤,ミコフェノール酸モフェチル,メチルプレドニゾロン)のみでは制御困難
・3剤併用療法に加え導入期にT細胞に対するモノクローナル抗体を用いると一部のドナー(CBA/N)で100%の生着が可能
・T細胞のコスティミュラトリーシグナルを阻害する薬剤を用いることで100%の生着が可能
・上記の結果はiPS細胞由来の移植片を用いた実験でも同様の結果
以上のように,MHCホモドナーからヘテロレシピエントへの移植における免疫反応の特徴とその制御方法について幾つかの知見を得た.今後はこれらの精度をさらに高めるとともにヒトにおける移植への応用を図る必要がある.
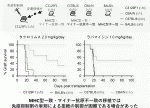
IV.おわりに
以上述べて来たように,われわれはこれまで移植(再生)医療の改善と向上に寄与するべく,主に免疫学的見地から研究を進めて来た.MHCホモドナーからヘテロレシピエントへの移植における免疫制御法に関しては,われわれが示した通り既に存在する薬剤を適切に組み合わせることによって拒絶反応を回避し安全に行うことが可能になるかもしれない.さらにコスティミュウトリーシグナル阻害等のアプローチをとることにより免疫寛容の誘導も可能となるかもしれない.細胞・組織移植は臓器移植に比して生着させることは一般的に困難であり,これらの研究は多能性幹細胞を用いた移植を成功させる上での重要な視点を提供していると考えている.
しかし,もちろんこれら(免疫学的研究)は移植(再生)医療の発展におけるごく一部分を担っているに過ぎない.本分野において最も重要な点は,移植した細胞・組織がレシピエント体内で十分に機能を発揮し,臓器移植に匹敵するほどの症状および予後改善をもたらす方法を見つけ出すことであろう.この点に関しては本特集でも取り上げられているように幾つかの先駆的取り組みがあり成果も報告されている4).しかし,未だ臓器移植に匹敵するほどの成績は上げられていないのが現状ではなかろうか.次世代のsurgeon-scientistはこの点に正面から取り組み解決することが望まれている.さらに,広義の再生医療(多能性幹細胞由来の細胞や組織の移植)だけではなく,狭義の再生-すなわち移植技術のみに頼ることなく真の機能回復をもたらすにはどうしたら良いか検討することも今後のsurgeon-scientistに求められている重要な課題ではないであろうか.われわれもさらに研究を継続し,これらの問題に取り組んでいきたいと考えている.
利益相反:なし
文献
1) Morris PJ: Transplantation — A Medical Miracle of the 20th Century. N Engl J Med, 351: 2678-2680, 2004.
2) Thomson JA, Itskovitz-Eldor J, Shapiro SS, et al.: Embryonic stem cell lines derived from human blastocysts. Science, 282: 1145-1147, 1998.
3) Takahashi K, Tanabe K, Ohnuki M, et al.: Induction of pluripotent stem cells from adult human fibroblasts by defined factors. Cell, 131: 861-872, 2007.
4) Yamanaka S: Pluripotent Stem Cell-Based Cell Therapy―Promise and Challenges. Cell Stem Cell, 27: 523-531, 2020.
5) Nakatsuji N, Nakajima F, Tokunaga K: HLA-haplotype banking and iPS cells. Nat Biotechnol, 26: 739–740, 2008.
6) Murata T, Wada H, Otsuka R, et al.: Establishment of an experimental model for MHC homo-to-hetero transplantation. Sci Rep, 10: 13560, 2020. https://doi.org/10.1038/s41598-020-69784-4
PDFを閲覧するためには Adobe Reader が必要です。