日外会誌. 122(5): 484-492, 2021
特集
大動脈弁疾患に対する外科的治療の現況
8.大動脈弁疾患の診断技術の進歩―急発展の大動脈弁狭窄症について―
|
1) 小倉記念病院 循環器内科 村上 直人1) , 磯谷 彰宏1) , 尾辻 豊2) , 白井 伸一1) |
高齢者の大動脈弁狭窄症(AS)が激増している.ASの有無は,心エコー図の弁尖開放で判断する.連続波ドプラ法を用いてASによる左室・大動脈圧較差(PG)を評価できる.PGは弁通過血流量に依存する.大動脈弁口面積(AVA)は血流量にあまり依存しない.心エコー図連続の式を用いて計測する.臨床症状・病像に上記検査所見等を加え,ガイドラインを参考に手術[外科的大動脈弁置換術(SAVR)・経カテーテル大動脈弁移植術(TAVI)]の適応を検討する.TAVI予定症例において,心臓CTは必須の検査である.大動脈弁複合体の立体的弁輪サイズを測定し,大動脈弁尖の石灰化を評価する.冠動脈の高さや左室流出路の石灰化・狭窄・アクセスルートも術前に把握する.解析ソフトと組み合わせ,人工弁サイズや留置位置を術前にプランし,術中においても術前CT画像を透視画像にオーバーレイさせ,カテーテル操作のナビゲーションが可能となる.血栓弁の評価に術後造影CTが有用である.近年,左室駆出率の低下がないが左室内腔が小さいために,駆出血流量が減少し(LF),AVAは狭いのにPGは小さい(LPG)症例が観察され,奇異性LFLPG ASと呼ばれる.奇異性LFLPG ASのAVA低下は偽重症という説があり,運動負荷心エコーを行い,真の重症と偽重症を鑑別することが必要と考える.
キーワード
大動脈弁狭窄症, マルチモダリティ画像診断
I.はじめに
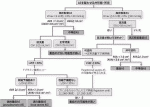
心臓弁膜症は,1)病気自体が変わった.以前(1980年代)はリウマチ性僧帽弁狭窄がメインであったが,現在では変性性大動脈弁狭窄症(AS)と弁逸脱による僧帽弁逆流がメインである.外科手術件数にみられるように弁膜症は絶対数として増加している.2)治療が変わった.以前は外科的弁置換術だけであったが,現在では外科的弁形成術・経カテーテル弁インターベンションが治療選択である.3)画像診断が大きく進歩した.もはや心カテーテルによる診断は行われず,心エコー図を中心としたマルチモダリティ画像診断が行われる.以前の診断は弁膜症の有無と重症度だけであった.現在は,「この症例の弁膜は,外科的形成術に適しているか?カテーテル治療に適しているか?」まで求められる.
II.ASの診断
1)原因・病態など
リウマチ性・先天性二尖弁および変性性ASが出現し,高齢者の変性性ASが最多である.圧負荷により左室肥大・機能低下を来たし,心不全・胸痛・失神や突然死を起こす.突然死もあり,症状出現後の死亡に至る期間が短く,適応の場合は速やかに治療する.
2)心エコー図
①定性診断
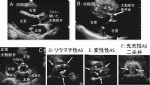
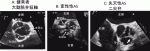
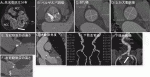
ASの有無は,左室長軸像で弁尖開放が良好かどうかで確認する(図1A,B).原因は大動脈弁短軸像で評価する(図1D-F).経食道心エコー図ではより詳細に評価可能である(図2A-C).
②重症度診断
A:圧較差
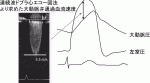
心エコー図連続波ドプラ法の弁通過血流速度によりASによる左室・大動脈圧較差(PG)を評価できる[PG(mmHg)=4×血流速度(m/s)2](図3).カテーテルを左室内に挿入すると脳塞栓が頻発するので1),カテーテルによるPG評価は通常行われない.
B:大動脈弁口面積(Aortic Valve Area:AVA)
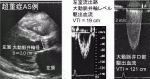
PGは通過血流量に依存する.血流量低下によりASは高度であってもPGが少なくなり,血流量増加によりASは軽度であってもPGが大きくなる.AVAは血流量にあまり依存しない.経胸壁心エコー図による連続の式を用いて計測する.図4の症例はAVA=0.49cm2と超重症ASである.
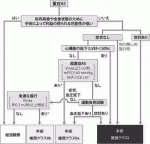
C:総合的重症度診断
PG・AVAを基に,負荷心エコーや後述の大動脈弁カルシウムスコアを考慮し,ガイドラインを参考に,重症度診断をする(図5,図6).
③その他の重要点
A:左室駆出率
通常の2断面シンプソン法で求める.
B:弁輪サイズ
人工弁のサイズ決定に重要である.まずは経食道(あるいは経胸壁)心エコーで,弁輪径を測定する.体格によるが,20mm以下の場合は人工弁サイズが小さくならないか術前の検討が必要である.
C:上行大動脈
石灰化が強いと外科手術で人工心肺を使用する際の大動脈クランプがリスクとなる.また二尖弁の場合等は上行大動脈拡大に気を付ける.
3)手術[外科的大動脈弁置換術(SAVR)・経カテーテル大動脈弁移植術(TAVI)]の判断
臨床症状・病像に上記検査所見等を加え,図6に示すガイドラインを参考に手術の適応が検討される.重症ASがあり,何らかの悪影響(症状・左室駆出率低下等)が出現すれば適応である.何らかの理由により他の開心術を行う場合には上記がなくてもSAVRの適応となる.
4)TAVIにおける診断:マルチモダリティ画像診断(3D CT)の有用性
TAVI予定症例において,心臓CTは必須である.腎機能低下例であっても実施に向け検討する.
①弁輪サイズ:大動脈弁複合体の解剖からわかるように大動脈弁複合体は上方からSino-tubular junction(ST-J),Anatomical ventriculo-arterial junction,そしてvirtual ringとなる(図7A).Virtual ringは無冠尖(NCC),左冠尖(LCC),右冠尖(RCC)の弁葉の底部を結んだ線となり,ここの面積・周長を測定する(図7B).以前は,2次元心エコー図長軸像の弁輪径を基に人工弁サイズを決定していたが,本来楕円(図7B)の大動脈弁輪径を過小評価する可能性があり,現在では3次元心臓CTを用いる.大動脈弁輪が正円に近づく収縮前期に計測する.各々の弁輪径に対応する生体弁サイズの選択はチャート(図7C,D)を用いる.
②大動脈弁尖の石灰化:図8Aに示すように,CTはエコーに比べ石灰化の描出に優れている.心電図同期下非造影CT画像各スライスでCT値が130HU以上,かつ1mm2以上の面積を有意な石灰化と定義し,4段階評価のCT値とその面積を積算し,そのスライスの石灰化スコアとし,全てのスライスの合計(Agatstonスコア)を算出する(推奨クラスⅡa).図8Aのように石灰化はNCCとLCCに強い.石灰化の量・分布から弁の広がりやすさ,合併症の発症リスクを推定する.二尖弁やrapheを評価する.さらには生体弁機能不全例の弁葉の性状評価も可能である.
③大動脈弁近傍の評価:弁サイズ把握の後に大動脈弁近傍の評価を行う.Valsalvaの径も測定し(図8B),人工弁留置の際に弁尖石灰化が収納されうるか,されなければ過拡張となり弁輪破裂を生じうるか評価する.図8CはST-Jの測定を行っているが長径・短径だけでなく石灰化をチェックする.上行大動脈は狭窄の有無だけでなくプラークの把握や拡大も重要である(図8D).著明拡大の場合にはカテーテル通過の際に大動脈解離を生じるリスクがある.ST-JやValsalva洞径といった周囲構造物のサイズを踏まえ,最終的に留置する人工弁サイズが決定される.冠動脈の高さも図8E,Fのように評価する.冠動脈口が低い場合には人工弁移植時に冠動脈が閉塞するリスクがあるので,冠動脈Protectionの準備を行う.左室流出路の石灰化は弁輪破裂の原因になりえ,左室流出路狭窄はTAVI弁留置後に圧負荷が解除され急速に悪化する事があり,術前にしっかり把握する.心臓横位の場合にはカテーテルの大動脈弁通過が難しい場合があり,あらかじめ大動脈の角度を測定する(図8G).
④アクセスルートの評価:アクセスルートの血管径,石灰化の分布と同時に浅大腿動脈と深大腿動脈が重要である(図8H,I).大腿アプローチ(TF)の場合には血管径に加え大腿動脈の分岐の高さも重要である.
⑤術前および術中ナビゲーション:解析ソフトと組み合わせることで,任意の断面解析や3次元評価を事前に行うことができ,留置後の状態を予測しながら人工弁サイズや留置位置をプランできる.術中においても,CTデータを透視画像にオーバーレイさせ,大動脈弁通過や左室内でのワイヤー操作時のナビゲーションが可能となる.
⑥術後の心臓CTは血栓弁の評価に有用である.心エコーにおける人工弁通過血流速度の増大が診断の契機となるが,血栓自体の描出には心臓CTが優れている.TAVI後に心臓CTを行うと,一定の割合(10~15%)で弁葉に付着する低吸収域を認め,HALT(hypo-attenuated leaflet thickening)と呼ばれる.現在TAVI後の抗血栓療法としては抗血小板薬が一般的であり,ルーチンでの抗凝固療法は推奨されていないが,抗凝固薬によってHALTが消失する.
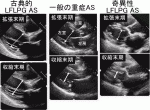
5)特殊な病態:低流量低圧較差(LFLPG)AS
以前よりAVAは狭いのにPGは小さい症例が観察されていた.AS末期に,左室が拡大し駆出率も悪くなり,低流量となってPGが減少する.現在では古典的LFLPG ASと呼ばれる(図9左).治療はハイリスクであるが,内科的にはとても予後が悪く,SAVRあるいはTAVIの適応である.
近年,左室駆出率の低下がないが左室内腔が小さく,駆出血流量が減少し(SV<35ml/m2),AVAは狭い(AVA<1.0cm2)のにPGは小さい(平均PG<40mmHg)症例が観察され2),奇異性LFLPG ASと呼ばれる(図9右).高齢ASでしばしばみられ,AS全体の数%~30%ぐらいと多い.この奇異性LFLPG ASが大問題となっている.予後不良という報告とそうでもないという報告が混在し,さらに原因不明である.「ASの結果,左室が小さくなる」と一般に解釈されるが,証明されていない.われわれは,「①ASに②全身の代謝低下(酸素消費量の低下)が(おそらく独立して)合併した状態」と考えている3).すなわち「ASにより左室が小さくなる」のではなく,「全身の代謝活性低下により心拍出量への需要が減少し,静脈還流(=心拍出量)や左室サイズが減少し,PGも減少する」という考えである.そのため,この病態にはASの解決と全身の代謝低下(しばしばイコール老化や衰弱)の解決が必要ではないか?と考える.さらに,奇異性LFLPG ASのAVA低下は血流量が少ないから大動脈弁が開かない(すなわち偽重症AS)という説があり,重大である.運動負荷により重症の奇異性LFLPG ASの3割~過半が偽重症と判明すると報告された4).現在は,多くの偽重症AS症例にSAVRあるいはTAVIが行われている可能性もあり,今後は奇異性LFLPG ASにルーチンに運動負荷心エコーを行い,真の重症と偽重症を鑑別することが必要と考える.

III.おわりに
ASの治療はTAVIの登場をはじめ大きく様変わりし,診断もマルチモダリティ画像診断の進歩が顕著で,ASの診療は進歩している.診断における最大の課題は奇異性LFLPG ASへの対応だと考える.運動負荷心エコー法が保険収載され(2,010点),普及が待たれる.
利益相反:なし
文献
1) Omran H , Schmidt H , Hackenbroch M , et al.: Silent and apparent cerebral embolism after retrograde catheterization of the aortic valve in valvular stenosis: a prospective randomized study. Lancet, 361: 1241-1246, 2003.
2) Hachicha Z , Dumesnil JG , Bogaty P , et al.: Paradoxical low-flow, low-gradient severe aortic stenosis despite preserved ejection fraction is associated with higher afterload and reduced survival. Circulation, 115: 2856-2864, 2007.
3) Onoue T , Iwataki M , Araki M , et al.: Insights into the mechanism of paradoxical low-flow, low-pressure gradient severe aortic stenosis: association with reduced O2 consumption by the whole body. Am J Physiol Heart Circ Physiol, 316:H840-H848, 2019.
4) Pérez del Villar C , Yotti R , Espinosa MÁ , et al.: The functional significance of paradoxical low-gradient aortic valve stenosis hemodynamic findings during cardiopulmonary exercise testing. JACC Cardiovasc Imaging, 10: 29-39, 2017.
PDFを閲覧するためには Adobe Reader が必要です。