日外会誌. 122(3): 330-334, 2021
特集
乳癌診療の現状と課題
8.がんゲノム医療の現状と課題
|
慶應義塾大学医学部 一般・消化器外科 林田 哲 , 山口 茂夫 , 北川 雄光 |
次世代シークエンサー(NGS)を中心とする技術の発展により,乳がん治療を含むがん医療にがん遺伝子パネル検査という新たな選択肢が提示され,臨床における利活用が進んでいる.多くの専門家・有識者による技術的・政策的な試みがなされた結果,この新たな医療を保険診療として国民へ提供され,一定の成果を得ているが,多くの問題点も指摘されている.技術的な問題点としては,解析アルゴリズムの相違やデータベース間の齟齬により結果の解釈が分かれることや,遺伝子パネルごとの特性が異なることなどが挙げられる.一方で,保険医療における遺伝子パネル検査の適応症例・タイミング・複数回検査の検討など,解決すべき問題点は多い.乳がん診療においても,遺伝子パネル検査の導入は進んでおり,活用例が増加しているが,様々な問題が浮上している.特に,乳がん診療のどの場面で遺伝子パネル検査を行うべきで,何をアウトカムとして医学的なエビデンスを構築すべきかについて,いまだにコンセンサスは得られていない.今後は,リキッドバイオプシーによる遺伝子パネル検査の導入も視野に入れ,適切な理解をもとに臨床応用することが求められている.
キーワード
がんゲノム医療, 遺伝子パネル検査, 乳癌, リキッドバイオプシー
I.はじめに
すでに乳癌治療においては,エストロゲン受容体やHER2受容体の発現状況というバイオマーカーを考慮した薬物療法が一般的であり,数々の医学的な検証も行われ,臨床医であればその恩恵は実感できるものである.これに加えて,がん遺伝子パネル検査という新たな選択肢が提示されることとなり,一般的にはこれを利用した医療はがんゲノム医療もしくはプレシジョンメディシンと呼称されている.その背景には,次世代シークエンサー(NGS)を中心とする技術を用いた網羅的なゲノム解析が安価に短時間で施行可能となったことがあげられる.これにより悪性腫瘍におけるドライバー遺伝子といわれる特徴的な遺伝子変異を同定し,個々の患者ごとに有効と思われる治療を選択することが可能となった.本稿では,このがんゲノム医療導入の経緯と現状を詳述し,今後どのような発展が見込まれるかを展望していく.
II.本邦へのがんゲノム医療導入の経緯
がんゲノム医療の保険診療への導入について,行政が行う政策的な面と,学術的な面が五月雨式に絡み合い,複雑な経緯をとっている.前者では,まず厚生労働省の審議会として「ゲノム情報を用いた医療等の実用化推進タスクフォース」が2015年11月から実用化に向けての議論が開始され,2017年3月からは新たに「がんゲノム医療推進コンソーシアム」において多数の有識者を交えてこの新しい医療を保険医療として定着するための議論が行われた.学会主導の事業としては,日本臨床腫瘍学会・日本癌学会・日本癌治療学会が合同で「3学会合同ゲノム医療推進タスクフォース」を2017年1月に発足させ,アカデミアの立場から行政や社会・国民に対して行うべき提言や,学会として行うべき事業について協議がなされている.また,当時平行して3学会が進めていた「がんゲノム医療ガイダンス作成事業」についても,タスクフォースへ段階を経て移管され,タスクフォースから3学会の理事会による承認を経て公開される流れを構築しているため,政策提言を含めて行政へ一定の発言力を保持していると考えられている.本事業により2017年10月にガイダンス第一版が発行され,2020年5月に大幅改訂された第2.1版が発行され,エキスパートパネル等の指針として活用がなされている1).今後はリキッドバイオプシーの保険医療への導入を見据えて,政策提言およびガイダンス改訂の検討がなされている段階である.また,本タスクフォースによる事業の一つとして,「社会に対する正しいがんゲノム医療の提供」の実現のために,「がんゲノムネット・ワーキンググループ」を組織し,厚生労働省のがん政策研究事業の支援を得て事業が進められた.この事業では,書籍を用いた情報ツールとして,「よくわかるがんゲノム医療」の発刊を予定している.ワーキンググループにより,Q&A項目,執筆者が選定され,複数の患者会の意見を取り入れ,パブリックコメントなどに留意しながら発刊される予定である.本書籍は公的研究費の成果物なので販売はせず無料配布がなされる.この事業により国民のがんゲノム医療に対する理解が進み,本検査に対する過度の期待や誤った認識が改善されると期待される.
III.がんゲノム医療の問題点
2017年にアメリカ食品医薬品局(FDA)に対外診断薬として承認をされているMSK-IMPACTは468種類の遺伝子を対象としたパネルシークエンスである.約10,000症例に対する診断の結果について報告がされ,37%が分子標的薬の推奨とされる変異(druggable gene alteration)を有し,実際には11%が治療紹介へ至ったとされている2).本邦では2019年からがんゲノム医療中核拠点病院を中心として,遺伝子パネル検査が保険診療として開始されており,今後その実績やデータが公表されると考えている.しかし,現時点においてもいくつかの技術的・政策的な問題点が指摘されている.
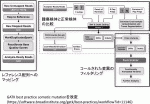
技術的な問題点は複数認められる.遺伝子パネル検査が施行されると,治療方針決定のためコールされた変異情報に対し治験・治療薬に関するアノテーション作業を行う必要がある.しかし,国内の治験・臨床試験情報へのアクセスが必要であるにも関わらず,使用されるのは海外のデータベースであるため,遺伝子変異情報に基づいた治験情報のデータベース作成が急務であると考えられる.また,データ処理の過程でfastqファイルをヒトの標準的な遺伝子配列と考えられているリファレンス配列に対してマッピングした後,変異コールへと進むのが一般的であるが(図1),この際に使用するアルゴリズムによって,コールされてくる変異遺伝子が変化することに注意すべきである3).さらに,腫瘍と正常検体の比較を行う場合と,腫瘍のみを用いた場合にはコールされてくる変異の数と質が全く異なる.すなわち,腫瘍検体のみの変異コールはゲノムリファレンスに対する変異をコールするために多くの偽陽性を含んでいることに注意が必要である.現時点で保険収載されているNCCオンコパネルは正常部とのいわば引き算を行うことで,個人特有のSingle Nucleotide Polymorphism(SNP)は原理的には除去されるが,FoundationOneは腫瘍部のみの検討であるため,自分のオーダーした遺伝子パネル検査がどちらを採用しているのかを理解しておく必要がある.また,変異コールし,SNPsを除去した段階では,治療標的とはなり得ない多くの偽陽性変異を含んでいる.最終的に真の治療標的となる変異を抽出するための方法には,1)病的な意義が報告されている遺伝子変異を抽出する,2)健常人が一定の確率で持つ変異は除外するという二つのアプローチが存在する.どちらの方法を採用するにしても,既存のデータベースの情報をもとに真なる治療ターゲットとなる変異の抽出を行うことになるが,抽出のために採用する原理・方法論によりフィルタリングされてくる遺伝子がかなり異なる.すなわち,使用されるデータベース,希少SNP頻度定義のためのカットオフ値など多くの変数の設定,また採用されるアルゴリズムなど,多くのバリエーションにより結果が同一にはならない.そのために,少なくとも変異コールを行うため,新しいアルゴリズムの検証や,更新されたデータベースを用いた再解析結果の検証を行うために,生データの登録と蓄積は計画的に行う必要がある.このように,いくつもの要因によって検査結果が変わるという可能性を理解し,これらを踏まえてどのように患者へ通知していくかという問題にも対応していく必要があると考えられる.
保険医療においてがん遺伝子パネル検査を行う際の問題点は,数多く存在する.その多くは3学会合同で作成された「次世代シークエンサー等を用いた遺伝子パネル検査に基づくがん診療ガイダンス 第2.1版」でも指摘されているが,遺伝子パネル検査の適応症例・タイミング・複数回検査の意義など,臨床に適応するにあたって非常に重要なトピックが挙げられる1).これらはどれも検査コストと密接に関連するものである.全エクソンシーケンスがすでに数万円で施行できることを考慮すると,その他にコストがかかると考えられる,キュレーション・アノテーションの自動化やエキスパートパネルの簡略化・省略などが今後課題になると考えられる.
IV.乳がん診療におけるがんゲノム医療の現状とリキッドバイオプシー
乳がんに限らず,がんゲノム医療の有用性を明確に示した臨床試験は認められない.試みられる臨床試験の形式として多いのは,癌腫によらず変異遺伝子により治療検討を行うバスケット試験と,同一の癌腫において,種々の薬剤効果を検討するアンブレラ試験であり,本邦でも施行されている.前者の代表的な臨床試験はSHIVA試験であり,遺伝子パネル検査に基づいた薬剤と主治医選択薬剤を投与する群を比較するランダム化比較試験である.対象は標準治療終了後の固形がん患者であり,主要評価項目は無増悪生存期間とされたが,有意な差が認められなかった4).本臨床試験の結果は残念ではあるが,遺伝子パネル検査を行うにあたり,適切な治療ラインの設定や,アウトカムの指標の適正性など,がんゲノム医療の有用性を検討するために有用な議論を提供した.
SAFIR01試験・SAFIR02試験は,進行再発乳がん患者を対象として行われたアンブレラ試験である.SAFIR01試験は遺伝子パネル検査を行うことで,その結果に基づいた標的治療が行われた患者の割合を明らかにすることを目的として施行された.その結果,Actionable変異の同定割合が46%であり,Druggable変異に基づいて治療が行われたのは13%であった5).一方でSAFIR02試験におけるPIK3CA変異を検討した報告がなされ,これによるとホルモン陽性・HER2陰性乳がんの28%,トリプルネガティブ乳がんの10%にPIK3CA変異が認められ,前者では化学療法への感受性が低く全生存率が不良であったが,後者では全生存率の改善が認められた6).現在はPIK3CA変異陽性かつホルモン陽性・HER2陰性進行再発乳がんを対象に,フルベストラント+アルペリシブ(PI3Kα特異的阻害薬)と化学療法の比較を行うSAFIR-PI3Kが進行中である.
遺伝子パネル検査の位置づけとして,乳がん診療ではこのようにPIK3CAに代表されるような,重要なシグナル伝達経路(PI3K-AKT-mTOR pathway,MAPK pathway等)や因子(CDK,BRCA1/2,HDAC等)に注目した検討が遺伝子パネル検査の結果の適用についても行われており,既存のコンパニオン診断薬の同定を一回の検査で済ませるような使用法が遺伝子パネル検査では現状主流といえるかもしれない.
今後実用化が期待されるリキッドバイオプシーについても,PIK3CA経路の変異に着目した検討が多い.血漿中のCirculating Tumor DNA(ctDNA)を検討するリキッドバイオプシーがコンパニオン診断薬として2019年5月にFDAにて承認された.本承認は,SOLAR-1試験に基づいたもので,ホルモン陽性HER2陰性の進行再発乳がんに対して,アルペリシブ+フルベストラント対プラセボ+フルベストラントの第3相無作為化二重盲検プラセボ比較対照試験である.主要評価項目であるPFSの中央値は,プラセボ+フルベストラント群では5.7カ月(95% CI:3.7~7.4)であったのと比較して,アルペリシブ+フルベストラント群では11.0カ月(95% CI:7.5~14.5)であった(HR 0.65;95%CI:0.50~0.85;p=0.001).腫瘍にPIK3CA変異を有しない患者には,PFSに関する有益性はみられなかった7).この結果をもとに承認された検査キットはPCRベースの検査システムで,11のホットスポットを検討するものであるが,リキッドバイオプシーの結果と,組織検体におけるPIK3CA変異の結果の一致率は72%(95% CI:67.5~75.2%)であった.PALOMA-3試験やNeoALTTO試験においてもリキッドバイオプシーによるPIK3CA変異について検討されたが,コンパニオン診断薬とするに足る結果は残念ながら得られなかった.
2020年8月には,Guardant360がタグリッソのコンパニオン診断薬としてFDAに承認され,NGSを組み合わせたリキッドバイオプシーとして初めて臨床で使用可能となった.Guardant360は55種類の遺伝子パネル検査としても使用することができるため,この結果をもとにした薬剤選択による診療が数年以内に実現する可能性が高く,これに向けてアカデミアからの政策提言や実際の検査フローなどの準備がなされるべきである.
V.おわりに
がんゲノム医療を患者に提供するには,保険診療で行うための適用対象・タイミング・コスト算定などの制度面を熟知するとともに,患者に結果を説明するために最低限の結果の解釈に関わる知識などをわきまえておく必要がある.しかし遺伝子パネル検査を取り巻く状況や技術の進歩はとても早く,知識や状況を常にアップデートするのは大変な作業である.特別な医師や患者のみが利用可能な医療とせず,これを適切に国民に提供するために多くの努力が必要であると考えられる.
利益相反
株:cBioinformatics株式会社
研究費:デンカ株式会社
文献
1) Naito Y, Aburatani H, Amano T et al.: Clinical practice guidance for next-generation sequencing in cancer diagnosis and treatment (edition 2.1). Int J Clin Oncol, 2021 Feb; 26(2): 233-283, 2020.
2) Zehir A, Benayed R, Shah RH, et al.: Mutational landscape of metastatic cancer revealed from prospective clinical sequencing of 10,000 patients. Nat Med, 23: 703, 2017.
3) Pabinger S, Dander A, Fischer M, et al.: A survey of tools for variant analysis of next-generation genome sequencing data. Brief Bioinform, 15(2): 256-278, 2014.
4) Le Tourneau C, Delord JP, Gonçalves A, et al.: Molecularly targeted therapy based on tumour molecular profiling versus conventional therapy for advanced cancer (SHIVA):a multicentre, open-label, proof-of-concept, randomised, controlled phase 2 trial. Lancet Oncol, 16(13): 1324-1334, 2015.
5) André F, Bachelot T, Commo F, et al.: Comparative genomic hybridisation array and DNA sequencing to direct treatment of metastatic breast cancer:a multicentre, prospective trial (SAFIR01/UNICANCER). Lancet Oncol, 15(3): 267-274, 2014.
6) Mosele F, Stefanovska B, Lusque A, et al.: Outcome and molecular landscape of patients with PIK3CA-mutated metastatic breast cancer. Ann Oncol, 31(3): 377-386, 2020.
7) Andre F, Ciruelos E, Rubovszky G, et al.: Alpelisib for PIK3CA-mutated, hormone receptor-positive advanced breast cancer. N Engl J Med, 380(20): 1929–1940, 2019.
PDFを閲覧するためには Adobe Reader が必要です。