日外会誌. 122(2): 172-178, 2021
特集
肝胆膵領域腫瘍におけるBorderline resectable/Marginally resectableとは
―術前治療の可能性について―
7.膵神経内分泌腫瘍
|
1) 京都大学大学院 医学研究科外科学講座 増井 俊彦1) , 高折 恭一2) |
膵神経内分泌腫瘍は,腫瘍の増殖スピードが緩やかで,局所の浸潤傾向が乏しいことが多いことから,膵癌におけるborderline resectableに相当する腫瘍でも根治的切除が可能なことが多い.ただし,腫瘍の不均一性のため,同じ膵神経内分泌腫瘍と診断されても,線維化が強く,膵癌と同様の切除限界となることがあることに注意が必要である.術前治療の必要性という観点からは,切除断端の陰性化よりも,腫瘍病態学的なmarginally resectableの病態がより重要である.すなわち1)門脈腫瘍栓に対して,腫瘍引き抜きおよび門脈合併切除は可能であってもいずれも肝転移を高率に来すこと,2)70%以上肝転移病変切除は非切除に比べて予後が改善するが,再発は必発であること,3)NECは切除のみでは非切除と同等の予後しか期待できず,何らかの追加治療を必要とするという点から,門脈腫瘍栓,肝転移,NECの各病態がmarginally resectableの状態と考えられる.前二者に関しては,本邦未承認ではあるものの,カペシタビン+テモゾロミド,PRRTが腫瘍縮小効果と長期無増悪生存期間が報告されている.欧米では,これらの治療法のmarginally resectable病変への効果も報告されていることから,今後の保険収載による適応拡大が待たれる.
キーワード
膵神経内分泌腫瘍 腫瘍栓, 肝転移切除, WHO2019
I.はじめに
膵神経内分泌腫瘍の“borderline resectable/marginally resectable”のカテゴリーの腫瘍は膵癌取扱い規約では膵癌に準じて扱われているが,浸潤傾向,局所再発率,遠隔転移の頻度が控えめであることから,同じ膵臓を由来としていても膵癌とは対象が異なる可能性が高い.
本稿では膵癌と比較しながらの膵神経内分泌腫瘍におけるmarginally resectableと考えうる腫瘍,また,術前治療のこれまでの報告と今後の方向性について概説する.
II.膵神経内分泌腫瘍におけるborderline resectable/marginally resectableとは
膵神経内分泌腫瘍は,腺房細胞や膵管細胞を由来とするいわゆる膵癌と異なり,β細胞をはじめとする内分泌細胞が由来であると考えられている.発生頻度は2010年に10万人のうち3.4人と報告されており1),膵神経内分泌腫瘍の5年生存率は欧米からは約60%と報告されている2).膵癌との違いで注目すべき点は,同じ膵神経内分泌腫瘍でも腫瘍の増殖力,浸潤性,遠隔転移の能力が腫瘍によって異なり,さらにこの違いは腫瘍内細胞それぞれによっても異なるという不均一性である3).例えば増殖力の指標であるKi67は腫瘍あるいは腫瘍細胞それぞれによって異なり,同じように遠隔転移を来しているUICC stageⅣの腫瘍であっても,その予後はKi67によって大きく異なる.この点は遺伝子学的にも,膵癌では「ビッグ4」とも言われるKRAS,p53,p16,DPC4の4遺伝子の変異を概ね来しているのに対し,神経内分泌腫瘍の高分化型では,そのような変異はなく,menin,DAXX/ATRXといった遺伝子の変異を10~20%の割合で来しており,クロマチン構造変異が関与していることから,腫瘍の多様性を来しているものと考えられている(表1)4)
~
6).従って,同一の膵神経内分泌腫瘍の病名であっても腫瘍の形態は大きく異なり,線維化を来す腫瘍から髄様型の腫瘍まで様々であり,個々の腫瘍における病態での個別判断を必要とすることが多い.また,膵癌とは異なる病態を呈する膵神経内分泌腫瘍では,borderline resectable/marginally resectableは外科的に根治術可能かの視点に加えて腫瘍学的に切除の意義が得られるか,と言った視点を考慮する必要がある.

III.膵癌における定義から
膵癌取扱い規約第7版では,SMAへの180度以内の浸潤,SMVの十二指腸下縁を越えない狭窄あるいは閉塞,CHAの再建可能な範囲での浸潤がborderline resectableと定義されている.
膵神経内分泌腫瘍では,根治切除という意味では同様の定義が適用可能であるが,腫瘍の性質として,動脈への浸潤に関しては圧排性のことが多く,CTなどによる術前画像よりも容易に剥離可能なことがある7)
8).また,門脈系への浸潤も同様に剥離可能なことが多いが,膵癌と異なり門脈内腫瘍栓として進展することがしばしばみられることに注意が必要である.腫瘍の不均一性を反映して,腫瘍によっては肝癌門脈腫瘍栓のように引き抜き可能なこともあるが,線維化を伴って浸潤し合併切除を必須とすることがある場合もあり,術前画像での評価は難しい.門脈腫瘍栓を伴っている場合,肝転移再発を高率に来すため,術後のフォローアップには注意が必要であり,このような症例がmarginally resectableとして術前化学療法の適応となる可能性がある.われわれも膵尾部膵神経内分泌腫瘍における左右門脈分岐部までの門脈腫瘍栓症例で術前治療を行い,門脈合併切除,その後2年,肝転移再発のない症例を経験している9).一方,手術先行にて容易に腫瘍の引き抜きが可能であったが,3カ月で肝転移再発を来した症例を経験しており,門脈腫瘍栓症例に対する術前療法の意義の検討が望まれる.以上,膵神経内分泌腫瘍では膵癌と比べて1)局所の浸潤傾向が弱いこと,2)門脈腫瘍栓では肝転移再発頻度が高い,と言う点から,局所進展におけるborderline resectableは門脈腫瘍栓が存在する症例と定義してもよく,このような腫瘍に対して術前療法,また,術後補助療法の意義がある可能性がある.一方,動脈合併切除を必要とする場合の切除成績についてはこれまで報告は殆ど無く,unresectableとしてコンバージョン手術可能となるまでの薬物用法の継続や,手術先行での動脈合併切除に対する予後への寄与の検討は今後の課題である.
IV.肝転移切除におけるmarginally resectable
膵神経内分泌腫瘍の遠隔転移部位の第一位は肝転移であり,次いでリンパ節転移である10).2010年代になるまで有効な治療法が少なかったため,以前より積極的に肝転移の切除が行われてきた.肝転移に対する切除の効果は,後ろ向きの検討でのみ有効性が報告されていることから選択バイアスが排除できず,議論のあるところではあるが,腫瘍量の95%以上の切除で有効であるという報告11)にはじまって,90%12),さらにはGraff-Bakerらが,80~89%,90~99%,100%切除のグループにおいて無増悪生存期間の成績が同等であることから70%以上切除可能であれば意義があると報告している13).70%の切除に意義があるとする報告はその後,二つあり,Maxellらはカットオフ値として70%と90%が無増悪生存期間に関与し,生存期間には70%以上切除が関与していること14),また,Scottらは70%以上切除が多変量解析にて有意に生存期間に関与していることを報告した15).これらの報告からは切除により70%の肝腫瘍量減量を見込める症例が肝切除におけるmarginally resectableと考えることができる.現在のところ,このような症例に対して術前療法により肝腫瘍切除後の成績向上が得られるかどうかの報告はなく,今後の課題である.しかしながら,そもそも肝転移切除後の5年再発率は84%から95%と報告され16)
17),10年ではほぼ全例が再発することから,肝転移切除は薬物療法をベースとした集学的遠隔転移治療の一環として位置づける必要があり,術前治療をはじめとした周術期治療を検討する必要がある.これまでの報告は全て後ろ向き解析でありエビデンスレベルが低いことから,多施設による検討が望まれる.現在日本神経内分泌腫瘍研究会では,プロジェクト研究として後ろ向き解析ではあるものの,全国のhigh volume centerからの過去17年の集計で222例の肝切除成績をまとめており,OSに関与する因子は多変量解析にてKi67が20%以上,年齢60才以上と報告している.今後,レジストリによる非切除肝転移も含めた前向きな解析が進むことを期待したい.
V.NEC/NETG3への切除適応
2017年に膵神経内分泌腫瘍に対してWHO規約が改訂され,WHO2010分類ではKi67が20%より大きい腫瘍は全てNECと分類されていたが,WHO2019分類では高分化型のNETG3と低分化型のNECに分けられることとなった(表2).同じKi67>20%であってもNETG3はNETG1やNETG2と同様の遺伝子変異を有しており病態も類似している一方,NECはKrasやRbの変異が半数程度認められ,異なる病態の腫瘍と考えられている5).このようなKi67が高値の腫瘍に対する原発巣の切除成績は根治術を行っても不良であり,NETG3とNECが混在していたWHO2010基準ではそもそも切除による意義があるかどうか報告が分かれていたが,WHO2019分類によりNETG3とNECが分けられることで,根治術による予後延長効果のある腫瘍の範囲が明らかとなってきた.すなわち,高分化型のNETG3では,NETG1やNETG2と同様,原発巣切除による予後延長効果が示され18),Ki67の値によってさらに予後が異なることが報告されている19)
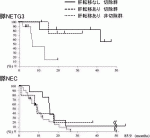
20).一方,低分化型であるNECにしぼった報告における切除に関する解析はこれまで皆無で,唯一の小数例の報告では,NECの切除が有効かどうかははっきりしていない(図1)21).従って,少なくともNECに関しては,切除単独では予後が期待しがたいという点で,marginally resectableと言える.本邦のガイドラインでも切除単独は推奨されず,周術期の化学療法が推奨されている.

VI.Neoadjuvant therapyの可能性
以上,膵神経内分泌腫瘍のborderline resectable/marginally resectableは1)門脈腫瘍栓,2)70%の肝転移切除可能症例,3)低分化型NECと考えられる.これらの中,低分化NECについては,治療法が限られ,高分化NETとはカテゴリーが異なるため,本稿では高分化NETに絞った術前治療の可能性を考察する.
本邦にて膵神経内分泌腫瘍に使用される薬剤は1)ソマトスタチンアナログ,2)分子標的剤,3)化学療法剤であるが,これまで症例報告レベルでは有効な報告が散見されるが,まとまった報告では術前治療の評価は一定していない.MD Andersonから報告された局所進行切除不能膵神経内分泌腫瘍356例の,5FU,ストレプトゾシン,ドキソルビシンを用いた治療効果は90%のSDと7%のPRを得,結果的に14例の切除が可能であり,切除されていない症例のOS中央値41カ月に比べて112カ月であったと報告している22).一方,最近のNCDBの膵神経内分泌腫瘍ステージ1~3の301症例の報告23)では,propensity score matchingで背景をそろえたところ術前治療の有効性は示せなかった.
膵神経内分泌腫瘍に著効する治療法が出現していないことが有効性を示せていない一つの理由であると考えられるが,近年,本邦では未承認であるものの有力な治療法が出現してきている.一つはカペシタビン+テモゾロミド24)
25)である.カペシタビンは5-FU系の薬剤,テモゾロミドは神経膠芽腫に使用されるアルキル化剤である.術前治療の報告としては局所進行膵神経内分泌腫瘍を対象としたE2211試験にて無再発生存期間を延長することが示され26),今後の展開が期待される.残念ながら本邦では保険承認される見通しは立っていないものの,学会,患者団体からの要望を行っている状態である.
もう一つはPeptide Receptor Radionuclide Therapy(PRRT,ペプチド受容体核医学内用療法)である.PRRTはソマトスタチン受容体に結合する分子に放射線同位元素を結合させ,ソマトスタチン受容体の高発現している神経内分泌腫瘍に集積し,放射線による殺傷効果を期待する内照射療法である.本治療はNETTER試験にてソマトスタチン受容体アゴニスト単独より有効であることが示され27),腫瘍縮小率は18%と報告された.ヨーロッパでは古くから使用されており,2018年には米国FDAで認可され,本邦でも治験が進んでいる.これまで4件のPRRTを用いた局所進行膵神経内分泌腫瘍に対する術前治療の報告が行われ,いくつかは肝転移も含まれた治療を行われている.最近の報告では23例の膵神経内分泌腫瘍に対してPRRTを行い,対照として23例の手術先行群と比較したところ28),PRRTを受けた23例のうち8例で切除が行われ,手術先行23例と比べてPRRT症例での無増悪生存期間の延長が認められた.29例を検討したオランダの研究では,PRRT後切除群では無増悪生存期間は69カ月,切除なしは49カ月と報告している29).この比較ではPRRT後切除が可能であれば切除を行った方が良好な予後を得る可能性を示唆し,術前治療というよりコンバージョンを狙った治療に適していることを示している.一方,肝転移についてのPRRTの術前治療としての有効性については今のところ不明である.本邦ではPRRTは治験の集積が終了し,今後の保険収載に向けた動きが進んでいる.PRRTが保険承認された暁には積極的な肝転移切除の多い本邦でのPRRTを用いた術前療法の可能性の検討が期待される.
VII.おわりに
膵神経内分泌腫瘍は高分化型の場合,他の癌腫と異なり,浸潤傾向がおとなしく,増大傾向もゆっくりであることが多く,解剖学的にborderline resectableとなっても切除できることが多い.一方,腫瘍学的に,門脈系への腫瘍栓形成,肝転移の切除,NECはmarginal resectableと考え,積極的に周術期治療を考慮していく必要がある.
利益相反:なし
文献
1) Ito T , Igarashi H , Nakamura K , et al.: Epidemiological trends of pancreatic and gastrointestinal neuroendocrine tumors in Japan:a nationwide survey analysis. J Gastroenterol, 50: 58-64, 2015.
2) Dasari A , Shen C , Halperin D , et al.: Trends in the Incidence, Prevalence, and Survival Outcomes in Patients With Neuroendocrine Tumors in the United States. JAMA Oncol, 3: 1335-1342, 2017.
3) Ito T , Hijioka S , Masui T , et al.: Advances in the diagnosis and treatment of pancreatic neuroendocrine neoplasms in Japan. J Gastroenterol, 52: 9-18, 2017.
4) Yachida S , Vakiani E , White CM , et al.: Small cell and large cell neuroendocrine carcinomas of the pancreas are genetically similar and distinct from well-differentiated pancreatic neuroendocrine tumors. Am J Surg Pathol, 36: 173-184, 2012.
5) Hijioka S , Hosoda W , Matsuo K , et al.: Rb Loss and KRAS Mutation Are Predictors of the Response to Platinum-Based Chemotherapy in Pancreatic Neuroendocrine Neoplasm with Grade 3:A Japanese Multicenter Pancreatic NEN-G3 Study. Clin Cancer Res, 23: 4625-4632, 2017.
6) Scarpa A , Chang DK , Nones K , et al.: Whole-genome landscape of pancreatic neuroendocrine tumours. Nature, 543: 65-71, 2017.
7) Prakash L , Lee JE , Yao J , et al.: Role and Operative Technique of Portal Venous Tumor Thrombectomy in Patients with Pancreatic Neuroendocrine Tumors. J Gastrointest Surg, 19: 2011-2018, 2015.
8) Pommier RF : Editorial:peptide receptor radionuclide therapy as neoadjuvant therapy for resectable or potentially resectable pancreatic neuroendocrine neoplasms. Surgery, 163: 768-769, 2018.
9) Sato A , Masui T , Sankoda N , et al.: A case of successful conversion from everolimus to surgical resection of a giant pancreatic neuroendocrine tumor. Surg Case Rep, 3: 82, 2017.
10) Nunez-Valdovinos B , Carmona-Bayonas A , Jimenez-Fonseca P , et al.: Neuroendocrine Tumor Heterogeneity Adds Uncertainty to the World Health Organization 2010 Classification:Real-World Data from the Spanish Tumor Registry (R-GETNE). Oncologist, 23: 422-432, 2018.
11) Foster JH , Berman MM : Solid liver tumors. Major Probl Clin Surg, 22: 1-342, 1977.
12) McEntee GP , Nagorney DM , Kvols LK , et al.: Cytoreductive hepatic surgery for neuroendocrine tumors. Surgery, 108: 1091-1096, 1990.
13) Graff-Baker AN , Sauer DA , Pommier SJ , et al.: Expanded criteria for carcinoid liver debulking: Maintaining survival and increasing the number of eligible patients. Surgery, 156: 1369-1376;discussion 1376-1367, 2014.
14) Maxwell JE , Sherman SK , O’Dorisio TM , et al.: Liver-directed surgery of neuroendocrine metastases:What is the optimal strategy? Surgery, 159: 320-333, 2016.
15) Scott AT , Breheny PJ , Keck KJ , et al.: Effective cytoreduction can be achieved in patients with numerous neuroendocrine tumor liver metastases (NETLMs). Surgery, 165: 166-175, 2019.
16) Mayo SC , de Jong MC , Pulitano C , et al.: Surgical management of hepatic neuroendocrine tumor metastasis:results from an international multi-institutional analysis. Ann Surg Oncol, 17: 3129-3136, 2010.
17) Sarmiento JM , Heywood G , Rubin J , et al.: Surgical treatment of neuroendocrine metastases to the liver:a plea for resection to increase survival. J Am Coll Surg, 197: 29-37, 2003.
18) Basturk O , Yang Z , Tang LH , et al.: The high-grade (WHO G3) pancreatic neuroendocrine tumor category is morphologically and biologically heterogenous and includes both well differentiated and poorly differentiated neoplasms. Am J Surg Pathol, 39: 683-690, 2015.
19) Sorbye H , Welin S , Langer SW , et al.: Predictive and prognostic factors for treatment and survival in 305 patients with advanced gastrointestinal neuroendocrine carcinoma (WHO G3):the NORDIC NEC study. Ann Oncol, 24: 152-160, 2013.
20) Galleberg RB , Knigge U , Tiensuu Janson E , et al.: Results after surgical treatment of liver metastases in patients with high-grade gastroenteropancreatic neuroendocrine carcinomas. Eur J Surg Oncol, 43: 1682-1689, 2017.
21) Yoshida T , Hijioka S , Hosoda W , et al.: Surgery for Pancreatic Neuroendocrine Tumor G3 and Carcinoma G3 Should be Considered Separately. Ann Surg Oncol, 26: 1385-1393, 2019.
22) Prakash L , Bhosale P , Cloyd J , et al.: Role of Fluorouracil, Doxorubicin, and Streptozocin Therapy in the Preoperative Treatment of Localized Pancreatic Neuroendocrine Tumors. J Gastrointest Surg, 21: 155-163, 2017.
23) Xie H , Liu J , Yadav S , et al.: The Role of Perioperative Systemic Therapy in Localized Pancreatic Neuroendocrine Neoplasms. Neuroendocrinology, 110: 234-245, 2020.
24) Devata S , Kim EJ : Neoadjuvant chemotherapy with capecitabine and temozolomide for unresectable pancreatic neuroendocrine tumor. Case Rep Oncol, 5: 622-626, 2012.
25) Ambe CM , Nguyen P , Centeno BA , et al.: Multimodality Management of “Borderline Resectable” Pancreatic Neuroendocrine Tumors:Report of a Single-Institution Experience. Cancer Control, 24: 1073274817729076, 2017.
26) Kunz PL , Catalano P , Nimeiri HS , et al.: A Randomized Study of Temozolomide or Temozolomide and Capecitabine in Patients With Advanced Pancreatic Neuroendocrine Tumors: A Trial of the ECOG-ACRIN Cancer Research Group (E2211). Pancreas, 48: 443, 2019.
27) Strosberg J , El-Haddad G , Wolin E , et al.: Phase 3 Trial of (177)Lu-Dotatate for Midgut Neuroendocrine Tumors. N Engl J Med, 376: 125-135, 2017.
28) Partelli S , Bertani E , Bartolomei M , et al.: Peptide receptor radionuclide therapy as neoadjuvant therapy for resectable or potentially resectable pancreatic neuroendocrine neoplasms. Surgery, 163: 761-767, 2018.
29) van Vliet EI , van Eijck CH , de Krijger RR , et al.: Neoadjuvant Treatment of Nonfunctioning Pancreatic Neuroendocrine Tumors with [177Lu-DOTA0,Tyr3]Octreotate. J Nucl Med, 56: 1647-1653, 2015.
PDFを閲覧するためには Adobe Reader が必要です。