日外会誌. 122(2): 140-146, 2021
特集
肝胆膵領域腫瘍におけるBorderline resectable/Marginally resectableとは
―術前治療の可能性について―
2.肝細胞がん
|
東京大学 肝胆膵外科 市田 晃彦 , 有田 淳一 , 長谷川 潔 |
脈管侵襲,肝外病変,手術時に腫瘍の遺残が予想される,などの予後不良因子を有する進行肝細胞癌はたとえ手術を行ったとしてもその予後は不良であり(腫瘍学的切除不能),ガイドラインによっては手術が推奨されていない.本邦の肝癌診療ガイドライン(2017年版)では門脈一次分枝までの脈管侵襲は手術適応とされているが肝外病変を有する症例や腫瘍遺残が想定される症例に外科的切除は推奨されていない.しかし他に有効な治療法が無いことから,一部の専門施設ではこのような進行肝細胞癌に対しても切除が行われてきた.このような腫瘍学的切除不能肝細胞癌や技術的切除不能肝細胞癌は何らかの非外科的治療を行った後に手術を行う,集学的治療による予後改善が模索されてきた.しかし従来の肝動脈化学塞栓療法やソラフェニブなどの薬物療法による前治療の効果は限定的であった.近年,経口マルチキナーゼ阻害剤のレンバチニブや抗PD-L1抗体アテゾリズマブとベバシズマブ併用療法など奏功率の高い新規薬物療法が報告されている.これらを用いた手術前治療やダウンステージング後のconversion surgeryによる予後の改善が期待されている.2019年7月より切除不能肝細胞癌に対してレンバチニブ投与後にどれほどの割合でconversion surgeryが可能となるかを検証する臨床試験(LENS-HCC試験)が開始されており,その結果が期待される.
キーワード
進行肝細胞癌, 術前補助療法, conversion surgery, レンバチニブ, アテゾリズマブ+ベバシズマブ併用療法
I.はじめに
肝細胞癌の切除適応はガイドラインごとに異なっており,明確なコンセンサスは得られていない.国内においても,他に有効な治療法がない場合には施設ごとの判断でガイドラインの適応を拡大し外科的切除が行われてきた.しかし,これらの症例の長期予後は決して満足できるものではなく,治療成績を向上させるために何らかの非外科的切除を組み合わせた集学的治療が模索されてきた.
本章では肝細胞癌の切除適応と成績向上のための前治療について,現状と将来の展望について述べることとする.
II.各種ガイドラインにおける肝細胞癌の切除適応と切除可能性
本邦の肝癌診療ガイドライン(2017年版)1)ではChild-Pugh分類がAもしくはB(肝予備能評価には肝障害度による評価を推奨)で肝外転移がなく,個数が3個以下の場合に切除が推奨されている(図1).腫瘍数の上限に関してはエビデンスレベルの高い報告は無いが,ラジオ波焼灼療法などの局所療法で受け入れられている3個までが良い適応と判断されている.また,腫瘍の大きさについては制限がなく,一次分枝までの門脈侵襲例は手術適応としてよい,とされている.サイエンティフィックステートメントには門脈侵襲が最も強力な予後因子である事が記載されているが,肝静脈腫瘍栓や胆管内腫瘍栓はその報告数も限られていることから,どの程度まで切除適応とするかは明確には示されていない.
一方,欧米でBCLCシステムをもとに提唱されたEASL Clinical Practice Guidelines2)ではvery early stageとearly stageで肝切除が推奨されている(図2).Very early stageは2cm未満単発の腫瘍,early stageは単発の腫瘍もしくは3個までの3cm未満の腫瘍とされており,ともに肝機能は腹水がなくChild-Pugh分類Aでperformance statusが0であることが必要条件とされている.Early stageの中でも特に肝切除が推奨されるのは単発の腫瘍であり,MELDスコア10未満の症例に門脈圧亢進症の程度や残肝容量,腹腔鏡などの低侵襲な方法が選択できるか,なども考慮して手術適応は判断すべき,としている.
また,香港から報告されたHKLC staging system3)では肝外病変のない症例においてChild-Pugh分類AもしくはBのearly tumor,Child-Pugh分類Aのintermediate tumorを外科的切除の適応としている.Early tumorは腫瘍径5cm以下,腫瘍数3個以下,肝内脈管侵襲がないものとし,intermediate tumorはこれらの3条件のうち一つを満たさないもの,と定義されている.
アジア太平洋肝臓学会(APASL)4)のガイドラインでは肝外病変がなく,Child-Pugh分類がAもしくはBの症例で切除が可能なものに肝切除が推奨されている.肝切除の適応決定には技術的側面と腫瘍学的側面を考慮する必要があり,良好な長期予後が得られる事が重要としている.予後に関する考え方や肝臓外科医の技術レベルは国や地域ごとに異なっており,社会背景も考慮する必要があるとし,腫瘍径や腫瘍数,脈管侵襲の有無などの具体的な切除基準は明言されていない.
このように,肝細胞癌の手術適応はガイドラインごとに異なっており,切除可能,切除不能について明確なコンセンサスは得られていない.本邦では肝切除術後30日以内の死亡率は0.7%と低く5),肝臓外科医の技術レベルが高い本邦のガイドライン1)に記載の手術適応は他のガイドラインよりもやや広くなっている.しかし,肝細胞癌切除症例数の多い国内の一部の施設ではさらにこの基準を超える進行肝細胞癌症例においても外科的切除が行われてきた.その最大の理由は他に有効な治療の選択肢がない事であるが,複数のガイドラインに記載されている脈管侵襲・肝外病変などの予後不良因子を有する症例や治癒切除が困難な症例の切除後長期予後は良好であるとは言い難い.日本肝癌研究会の第21回全国原発性肝癌追跡調査報告6)によると,肉眼的門脈侵襲を有する症例の切除後5年生存率はVp2症例で35.7%,Vp3症例で30.5%,Vp4症例で17.1%であった.また,切除後5年生存率は肝外病変を有するStageⅣB症例では27.2%,腫瘍遺残のある治癒度Cの症例では31.5%であった.このようにたとえ切除できたとしても切除後の予後が不良である症例は腫瘍学的切除不能症例と考えられ,何らかの非外科的治療と組み合わせた集学的治療による治療成績の向上が望まれる.また,技術的切除不能症例においても何らかの非外科的治療によるダウンステージングの後に切除を行うconversion surgeryによる治療成績の向上が望まれている.
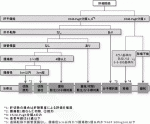
III.外科的切除の前治療
技術的に切除可能な肝細胞癌の切除後予後改善を目的とした術前補助療法は肝癌診療ガイドライン1)では推奨されていない.全身化学療法を術前補助化学療法として施行し,その有効性を検証したエビデンスレベルの高い報告はほとんど認められない,としている.また,術前補助療法として肝動脈塞栓療法(TAE)/肝動脈化学塞栓療法(TACE)を施行した場合,単回では肝機能の低下もわずかで合併症罹患率も低く,腫瘍壊死や縮小効果により,進行肝細胞癌で切除率を向上させる可能性はあるが,予後改善効果については一定の見解は得られていない7)
~
10).TAE/TACEを術前補助化学療法として有効であるとする論文のほとんどが2000年前後までに発表されているが,エビデンスレベルの高い論文は少ない.一方,無効とする論文には2000年以降のエビデンスを伴ったRCTやメタアナリシスが含まれている.術前肝動注化学療法についても,再発抑制や生存率の改善に対する有効性は認められていない11).Liらは門脈本幹に腫瘍栓を有する肝細胞癌に対する術前放射線治療の有効性を検討し,術前放射線治療施行群で肝切除後の再発率および肝細胞癌関連死亡率は低く,門脈本幹に腫瘍栓を有する進行肝細胞癌に対する放射線+肝切除の可能性を報告している12).
技術的切除不能症例においてconversion surgeryを企図して行った治療の有効性に関する報告も限られている.Zhangらは831例の切除不能肝細胞癌患者に対してTACEを行い,82例でダウンステージングが可能であり43例に外科的切除を行ったと報告している13).Salvage surgeryを受けた43例とsalvage surgeryを拒否した39例の比較ではそれぞれ生存期間中央値は49カ月と31カ月でありsalvage surgery施行群の方が生存期間は長かったとしている(P=0.027).Yoshimotoらは38例の切除不能肝細胞癌患者にソラフェニブを投与し2例でconversion surgeryが可能となり,これらの2例では良好な長期成績が得られたことを報告している14).比較ゲノムハイブリダイゼーション法で線維芽細胞増殖因子4が陽性の症例では特にソラフェニブの効果が期待できる可能性があるとしている.ソラフェニブを用いたconversion surgeryは他に7例,報告が確認されている.このようにTACEやソラフェニブなど既存の治療後のconversion surgeryは報告数が限られており,定まった治療とは言えないのが現状である.
IV.新規薬物による術前薬物療法の可能性
本邦で2018年3月に保険承認された経口マルチキナーゼ阻害剤のレンバチニブは従来使用されてきたソラフェニブと比較し,全生存率における非劣性と奏功率・無増悪生存期間の優越性が示された(REFLECT試験)15).生存期間中央値はレンバチニブ群で13.6カ月,ソラフェニブ群で12.3カ月であった.mRECISTによる独立画像評価においてレンバチニブ群は40.6%と高い奏功率が報告されている一方でソラフェニブ群の奏功率は12.4%であった(P<0.0001).無増悪生存期間の中央値はレンバチニブ群で7.3カ月,ソラフェニブ群で3.6カ月とレンバチニブ群の方が優位に長かった(P<0.0001).治療に関連したgrade3以上の有害事象はレンバチニブ群の57%,ソラフェニブ群の49%にみられたとしている.
また,抗PD-L1抗体アテゾリズマブとベバシズマブの併用療法は2020年9月25日に保険承認された.ソラフェニブと比較して有意に全生存期間と無増悪生存期間を延長させ,死亡リスクを42%減少させる事が報告されている(IMbrave150試験)16).アテゾリズマブ+ベバシズマブ群とソラフェニブ群の1年生存率はそれぞれ67.2%と54.6%,無増悪生存期間の中央値はそれぞれ6.8カ月と4.3カ月であった.mRECISTでの奏功率はアテゾリズマブ+ベバシズマブ群33.2%,ソラフェニブ群13.3%であった.Grade3以上の有害事象はアテゾリズマブ+ベバシズマブ群の56.5%,ソラフェニブ群の55.1%にみられたとされている.
他にも血管新生阻害薬と免疫チェックポイント阻害薬の併用療法としてレンバチニブ+ペムブロリズマブ,レンバチニブ+ニボルマブ,カボザンチニブ+ニボルマブ等の併用療法や,免疫チェックポイント阻害薬同士の併用療法としてイピリムマブ+ニボルマブやトレメリムマブ+デュルバルマブ等の臨床試験が進行中である.これらの新規薬物療法は,その高い奏功率から切除不能症例の切除後成績改善およびconversionに利用できることが期待される.
V.新規薬物によるconversion surgeryの臨床試験
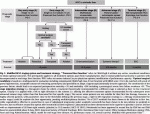
2019年7月より,切除不能肝細胞癌に対しレンバチニブ投与を行う事で,どの程度conversion surgeryが可能になるかを調べる多施設共同研究(LENS-HCC試験,臨床研究実施計画番号jRCTs031190057)が行われている.参加施設は当科を含め,国内の16施設である.登録のための腫瘍条件はA)肝内脈管侵襲を認めるもの(Vv2-3,Vp2-4,B2-4),B)肝内の切除可能病変に肝外病変を伴うもの,C)脈管侵襲を伴う肝内病変と肝外病変を伴うもの,D)全ての腫瘍切除は困難だが生存便益もしくはQOL改善を期待して切除が想定されるもの,E)肝内病変は認められないか,または制御可能であるが肝外病変を認めるもの,の5パターンを想定し,各参加施設で切除不能と判断された症例を対象としている(図3).その他の主要な適格基準は1)20歳以上であること,2)レンバチニブ投与・外科的切除が可能な全身状態が保たれていること,3)過去に肝細胞癌に対して全身薬物療法を受けていないこと,である.症例登録の後,レンバチニブ投与を開始し,4週間ごとに造影CTもしくはMRIにて治療効果判定を行う.8週間のレンバチニブ投与の後,外科的切除の可能性を検討する(図4).主要評価項目は外科的切除率であり,副次評価項目は治癒切除率,全生存期間,薬物療法後のICG 15分停滞率,などである.目標症例数は50例で,2020年9月現在,31例が登録されている.


VI.おわりに
脈管侵襲,肝外病変,腫瘍遺残などの予後不良因子を有する腫瘍学的切除不能症例や技術的切除不能症例に対しては予後改善のための集学的治療が望まれる.既存の非外科的治療は奏功率が低く,術前治療の効果は限定的であった.レンバチニブやアテゾリズマブ+ベバシズマブなど,奏功率の高い新規薬物療法を前治療として行う事で予後の改善や切除率の改善が得られる可能性がある.他にも様々な新規薬物の有効性が検証されている.LENS-HCC試験のような新規薬物療法と外科的治療を組み合わせた臨床研究の結果も期待されるところである.
本稿で紹介したLENS-HCC試験はエーザイ株式会社から資金提供を受けて行われている.
利益相反:なし
文献
1) 日本肝臓学会編:肝癌診療ガイドライン2017年版(補訂版).金原出版,東京,2020.
2) European Association for the Study of the Liver. EASL Clinical Practice Guidelines: Management of hepatocellular carcinoma. J Hepatol, 69: 182-236, 2018.
3) Yau T , Tang VY , Yao TJ , et al.: Development of Hong Kong Liver Cancer staging system with treatment stratification for patients with hepatocellular carcinoma. Gastroenterol, 146: 1691-1700, 2014.
4) Omata M , Cheng AL , Kokudo N , et al.: Asia-Pacific clinical practice guidelines on the management of hepatocellular carcinoma:a 2017 update. Hepatol Int, 11: 317-370, 2017.
5) Kakeji Y , Takahashi A , Hasegawa H , et al.: Surgical outcomes in gastroenterological surgery in Japan:Report of the National Clinical Database 2011-2018. Ann Gastroenterol Surg, 4: 250-274, 2020.
6) 日本肝癌研究会:第21回全国原発性肝癌追跡調査報告(2010〜2011).2020.
7) Minagawa M , Makuuchi M , Takayama T , et al.: Selection criteria for hepatectomy in patients with hepatocellular carcinoma and portal vein tumor thrombus. Ann Surg, 233: 379-384, 2001.
8) Choi SB , Kim KS , Park YN , et al.: The efficacy of hepatic resection after neoadjuvant transarterial chemoembolization (TACE) and radiation therapy in hepatocellular carcinoma greater than 5 cm in size. J Korean Med Sci, 24: 242-247, 2009.
9) Kang JY , Choi MS , Kim SJ , et al.: Long-term outcome of preoperative transarterial chemoembolization and hepatic resection in patients with hepatocellular carcinoma. Korean J Hepatol, 16: 383-388, 2010.
10) Paye F , Jagot P , Vilgrain V , et al.: Preoperative chemoembolization of hepatocellular carcinoma:a comparative study. Arch Surg, 133: 767-772, 1998.
11) Mathurin P , Raynard B , Dharancy S , et al.: Meta-analysis:evaluation of adjuvant therapy after curative liver resection for hepatocellular carcinoma. Aliment Pharmacol Ther, 17: 1247-1261, 2003.
12) Li N , Feng S , Xue J , et al.: Hepatocellular carcinoma with main portal vein tumor thrombus:a comparative study comparing hepatectomy with or without neoadjuvant radiotherapy. HPB(Oxford), 18: 549-556, 2016.
13) Zhang Y , Huang G , Wang Y , et al.: Is salvage liver resection necessary for initially unresectable hepatocellular carcinoma patients downstaged by transarterial chemoembolization? Ten years of experience. Oncologist, 21: 1442-1449, 2016.
14) Yoshimoto T , Imura S , Morine Y , et al.: The outcome of sorafenib therapy on unresectable hepatocellular carcinoma:experience of conversion and salvage hepatectomy. Anticancer Res, 38: 501-507, 2018.
15) Kudo M , Finn RS , Qin S , et al.: Lenvatinib versus sorafenib in first-line treatment of patients with unresectable hepatocellular carcinoma:a randomised phase 3 non-inferiority trial. Lancet, 391: 1163-1173, 2018.
16) Finn RS , Qin S , Ikeda M , et al.: Atezolizumab plus Bevacizumab in Unresectable Hepatocellular Carcinoma. N Engl J Med, 382: 1894-1905, 2020.
PDFを閲覧するためには Adobe Reader が必要です。