日外会誌. 122(1): 43-47, 2021
特集
肺・胸腺神経内分泌腫瘍の治療
7.胸腺神経内分泌腫瘍の治療
|
大阪大学大学院 医学系研究科外科学講座呼吸器外科学 新谷 康 , 舟木 壮一郎 , 大瀬 尚子 , 狩野 孝 , 福井 絵里子 , 木村 賢二 , 南 正人 |
胸腺神経内分泌腫瘍は胸腺上皮性腫瘍の2~5%と稀な腫瘍であり,WHO分類第4版(2015年)では小細胞癌,大細胞神経内分泌癌,異型カルチノイド,定型カルチノイドに分類される.治療は外科切除が第一選択であり,腫瘍を含めた胸腺全摘にリンパ節郭清を行うことを原則とし,完全切除の可否が胸腺神経内分泌腫瘍の予後に最も影響するため,腫瘍進展に応じて隣接臓器合併切除が行われる.組織型によっては術前導入療法,術後補助療法が考慮されるが,適応や有効性に関するまとまった報告はない.切除不能例や再発例に対する治療として薬物療法が施行され,小細胞癌,大細胞神経内分泌癌に対してプラチナ製剤を中心とする化学療法が,カルチノイドでは分子標的薬mammalian target of rapamycin(mTOR)阻害薬などが使用され,治療選択肢が広がっている.また,多発性内分泌腫瘍症(multiple endocrine neoplasia:MEN)1型の2.5~5%に胸腺カルチノイドを合併し,予後を規定する因子であるため,胸腺神経内分泌腫瘍の早期発見,治療が重要である.本稿では,胸腺神経内分泌腫瘍の診断・治療についての最新の知見に加え,外科手術の役割と成績について述べたい.
キーワード
胸腺神経内分泌腫瘍, 手術成績, 多発性内分泌腫瘍症1型
I.はじめに
胸腺上皮性腫瘍は,WHO分類で核異型,組織構造,形質発現により胸腺腫,胸腺癌,胸腺神経内分泌腫瘍(Neuroendocrine tumor;NET)に分類され,胸腺NETは胸腺上皮性腫瘍の2~5%である1).最新のWHO分類第4版(2015年)では,胸腺NETを小細胞癌,大細胞神経内分泌癌,異型カルチノイド,定型カルチノイドに分類している.定型カルチノイドは低悪性度,異型カルチノイドは中悪性度,小細胞癌と大細胞神経内分泌癌は高悪性度(低分化型神経内分泌癌)に大別される.胸腺NETの治療は外科切除が第一選択であり,切除不能例や再発例に対しては薬物療法を施行されるが治療に難渋することが多い2).また,多発性内分泌腫瘍症(multiple endocrine neoplasia:MEN)1型(MEN1)の症例中の胸腺NETの発生頻度は2.5~5%と報告されており,胸腺NETの治療が予後を規定する因子として重要である3).本章では,胸腺NETの診断・治療について述べる.
II.胸腺NET診断
胸腺NETは稀な腫瘍であり,米国の報告においては,人口10万人あたり0.02人程度の発症とされる4).欧米のデータベースを用いた205例の胸腺NETの報告では,胸腺NETの組織分類別の頻度は定型カルチノイド28%,異型カルチノイド40%,低分化型神経内分泌癌28%であった2).一方,われわれの関連施設(10施設)で最近30年間の胸腺NETを調査したところ30例が報告され,中央病理診断によって定型カルチノイド7例,異型カルチノイド11例,大細胞神経内分泌癌3例,小細胞癌9例に分類された5).
胸腺NET症例の大部分は無症状であり,画像検査で偶然発見されることが多い.また,胸腺カルチノイドは傍腫瘍症候群の精査で発見されることがあり,胸腺カルチノイド症例の30%に異所性ACTH産生によるCushing症候群,25%にMEN1が合併する6).
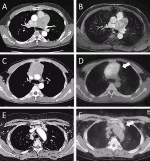
症状や画像所見よりNETが疑われた場合,MEN1を合併する症例が少なくないことから,副甲状腺,膵臓,下垂体腫瘍に関する画像・血液検査を行う必要がある.胸腺NETの腫瘍マーカーとしては,NSE(neuron specific enolase)やpro GRPなどが用いられるが感度は低い.また他の縦隔腫瘍との鑑別のため,抗アセチルコリンレセプター抗体など他の胸腺腫瘍の診断に参考になる血液検査を行う.胸腺NETの画像所見では,比較的大きな辺縁不整な腫瘤を認めることが多く,CTもしくはMRIでの造影効果は不均一である(図1A,B).さらに悪性度が増すにつれ,隣接臓器への局所浸潤,リンパ節転移,胸水や心嚢液貯留を伴うことがある.また,異型カルチノイドでは壊死や嚢胞成分,出血を認めることが多い7).Fluorodeoxyglucose-positron emission tomography(FDG-PET)は悪性度診断に有用とされるが(図1C,D),他の胸腺腫瘍との鑑別は困難である.また,MEN1症例では,胸腺カルチノイドの早期発見,治療に努める必要があり,定期的な胸部画像検査が推奨されている8).
ソマトスタチン受容体シンチグラフィー(Somatostatin receptor scintigraphy:SRS)は,ソマトスタチン類似体に放射性物質を付けた薬剤で,ソマトスタチン受容体の分布を画像化して診断する検査である(図1E,F).病巣検出力が高いことから,治療前の病巣診断,転移・再発診断に加え,後述のソマトスタチン類似薬による治療の適応判定にも用いられている.また,完全切除ができない縦隔腫瘍に対しては,治療方針決定のために針生検や外科的生検による病理診断が必須である.外科的生検は腫瘍播種が危惧されるため,当科では完全切除が見込まれる症例には,胸腔鏡下生検を行うより,胸腔内操作を避けるため腫瘍の位置に応じて傍胸骨アプローチで縦隔に至り生検を行うことが多い.病理診断に関して,HE染色に加え,クロモグラニンA,シナプトフィジンの神経内分泌マーカーの免疫染色を行う.HE染色では,通常の悪性腫瘍に比較し,類円形のおとなしい核を有し,リボン状,索状,ロゼット形成といった特徴的な細胞配列を示す.また免疫組織染色における特徴は,クロモグラニン,シナプトフィジン,NCAM(CD56)の発現が知られている.また,神経内分泌腫瘍の分化度の指標として,核分裂像の数とMIB-1(Ki-67)の陽性率があげられ,予後とも関連する9).悪性度が高い病変ほど,増殖マーカーは高頻度に発現し,神経内分泌マーカーの発現は低下する.
III.胸腺NETの治療
胸腺NETの根治的治療法は手術による完全切除しかない.手術は腫瘍を含めた胸腺全摘が原則であるが,拡大胸腺摘出術に準じた範囲で胸腺を切除することが多い.腫瘍の悪性度を考慮すると,胸腔鏡手術などの低侵襲手術は勧められない.またリンパ節郭清が有効であると報告されており,上大静脈,大動脈周囲の前縦隔リンパ節,または進行度に応じて気管周囲,分岐部や頸部にかけてのリンパ節郭清が行われる6)
10).正中切開により縦隔に至ることが標準的なアプローチ法であるが,腫瘍進展によっては正中切開に側方開胸を加えて,胸腔側の視野を確保する必要がある.他臓器浸潤部位は可能な限り合併切除を行い,腫瘍を完全切除すべきであり,人工心肺を用いた大血管合併切除を伴う拡大手術も報告されている11).低分化型神経内分泌癌に対しては術前導入療法が完全切除に有用である場合があるが,その適応や有効性に関するまとまった報告はない.また,症例に応じて術後療法が施行されているが,有効性を明確に示した報告はない12).主な外科成績の報告を表1に示した.腫瘍の完全切除率は対象症例の内訳が影響すると考えられるが,手術症例の39~97%と報告されている2)
5)
9)
12)
~
14).
切除不能例に対しては薬物療法が施行されるが,標準的な化学療法レジメンはない.高悪性度の胸腺NETに対してではプラチナ製剤を中心とする化学療法が基本となり,エトポシドやイリノテカンを併用する化学療法を行うことが多い.また,カルチノイドに対して,分子標的薬mammalian target of rapamycin(mTOR)阻害薬エベロリムスやソマトスタチン類似薬などの治療が行われる.本邦では,ソマトスタチン類似薬は,カルチノイド症状の改善を目的にする場合に使用することが可能である.さらに,欧米では,ソマトスタチン類似体に放射性物質を付けた薬剤による放射性核種標識ペプチド治療(Peptide receptor radionuclide therapy;PRRT)が施行されているが,本邦では未承認である.また,進行胸腺カルチノイド症例に対し,エベロリムスおよびソマトスタチン類似薬であるパシレオチドを単剤もしくはその両方を併用した場合に,併用群でより効果が高いことが報告された15).
IV.胸腺NETの予後
外科的完全切除の可否が胸腺NETの予後に最も影響する12).完全切除後にも,局所再発や遠隔転移を認め,再発率は26~83%であり,5年生存率は23~84%である(表1).腫瘍サイズ,進行度,組織型が予後に影響するとする報告もあるが,解析する症例が限られており正確な知見は得られていない.またCushing症候群やMEN1を合併している場合には予後不良とされる9).再発症例に対しては一般的に薬物療法や放射線療法が行われるが,再発巣の完全切除が可能な場合には手術による局所治療を選択する場合がある16).

V.おわりに
胸腺NETは希少疾患であるため,治療に関する無作為化比較試験の実施が困難であり,エビデンスを有する治療法の確立は困難である.一方で,胸腺NETの治療は外科切除が第一選択であり,外科的完全切除の可否が予後に最も影響することから,拡大手術を含めた治療戦略を積極的に選択しているのが現状である.したがって,胸腺NETを初期の段階で発見し,適切な手術で治療することが極めて重要である.
利益相反:なし
文献
1) Marx A , Chan JK , Coindre JM , et al.: The 2015 World Health Organization Classification of Tumors of the Thymus: Continuity and Changes. J Thorac Oncol, 10(10): 1383-1395, 2015.
2) Filosso PL , Yao X , Ahmad U , et al.: Outcome of primary neuroendocrine tumors of the thymus: a joint analysis of the International Thymic Malignancy Interest Group and the European Society of Thoracic Surgeons databases. J Thorac Cardiovasc Surg, 149(1): 103-109 e2, 2015.
3) Sakurai A , Suzuki S , Kosugi S , et al.: Multiple endocrine neoplasia type 1 in Japan: establishment and analysis of a multicentre database. Clin Endocrinol (Oxf), 76(4): 533-539, 2012.
4) Yao JC , Hassan M , Phan A , et al.: One hundred years after “carcinoid”:epidemiology of and prognostic factors for neuroendocrine tumors in 35,825 cases in the United States. J Clin Oncol, 26(18): 3063-3072, 2008.
5) Ose N , Maeda H , Inoue M , et al.: Results of treatment for thymic neuroendocrine tumours:multicentre clinicopathological study. Interact Cardiovasc Thorac Surg, 26(1): 18-24, 2018.
6) Jia R , Sulentic P , Xu JM , et al.: Thymic Neuroendocrine Neoplasms:Biological Behaviour and Therapy. Neuroendocrinology, 105(2): 105-114, 2017.
7) Shimamoto A , Ashizawa K , Kido Y , et al.: CT and MRI findings of thymic carcinoid. Br J Radiol, 90(1071): 20150341, 2017.
8) Thakker RV , Newey PJ , Walls GV , et al.: Clinical practice guidelines for multiple endocrine neoplasia type 1 (MEN1). J Clin Endocrinol Metab, 97(9): 2990-3011, 2012.
9) Cardillo G , Rea F , Lucchi M , et al.: Primary neuroendocrine tumors of the thymus: a multicenter experience of 35 patients. Ann Thorac Surg, 94(1): 241-245;discussion 5-6, 2012.
10) Girard N , Ruffini E , Marx A , et al.: Thymic epithelial tumours:ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol, 26 Suppl 5:v40-55, 2015.
11) Ose N , Inoue M , Morii E , et al.: Multimodality therapy for large cell neuroendocrine carcinoma of the thymus. Ann Thorac Surg, 96(4):e85-e87, 2013.
12) Corsini EM , Mitchell KG , Sceusi EL , et al.: Multidisciplinary treatment of thymic neuroendocrine tumors: surgery remains a key component. J Thorac Dis, 11(8): 3391-3398, 2019.
13) Tiffet O , Nicholson AG , Ladas G , et al.: A clinicopathologic study of 12 neuroendocrine tumors arising in the thymus. Chest, 124(1): 141-146, 2003.
14) Ma K , Liu Y , Xue Z , et al.: Treatment, prognostic markers, and survival in thymic neuroendocrine tumors:A single center experience of 41 patients. Medicine (Baltimore), 96(43):e7842, 2017.
15) Ferolla P , Brizzi MP , Meyer T , et al.: Efficacy and safety of long-acting pasireotide or everolimus alone or in combination in patients with advanced carcinoids of the lung and thymus (LUNA):an open-label, multicentre, randomised, phase 2 trial. Lancet Oncol, 18(12): 1652-1664, 2017.
16) Filosso PL , Ruffini E , Solidoro P , et al.: Neuroendocrine tumors of the thymus. J Thorac Dis, 9(Suppl 15):S1484-S1490, 2017.
PDFを閲覧するためには Adobe Reader が必要です。