日外会誌. 122(1): 26-31, 2021
特集
肺・胸腺神経内分泌腫瘍の治療
4.異型カルチノイドの治療
|
1) 京都大学大学院 医学研究科呼吸器外科 毛受 暁史1) , 吉澤 明彦2) , 伊達 洋至1) |
気管支肺カルチノイドは,神経内分泌腫瘍の一種であり,中でも低~中悪性度に分類される.さらに定型カルチノイドおよび異型カルチノイドに分類され,異型カルチノイドの方が予後不良である.現在の一般的治療方針は,切除可能症例については外科的切除となっており,特に異型カルチノイドについては,葉切除が標準治療と考えられる.切除不能例に対する薬物療法も徐々に治療選択肢が広がっているが,第一選択治療薬などについてのエビデンスは十分ではない.さらに,局所進行症例についてのmultimodalityな治療方針の確立が今後の重要な課題である.
キーワード
異型カルチノイド, 神経内分泌腫瘍, 外科手術, 全身治療
I.はじめに
異型カルチノイド(Atypical Carcinoid, AC)は,低悪性度肺神経内分泌腫瘍であるカルチノイドに含まれる.過去には非定型カルチノイドの名称であったが,2015年版WHO分類および2017年版肺癌取り扱い規約の組織分類において,神経内分泌腫瘍群がまとめられた際,異型カルチノイドへと変更された.定義は変更されておらず,核分裂像の多寡と壊死の有無により,定型(Typical Carcinoid, TC)またはACに分類される.ACはTCと比べても稀な腫瘍であり,治療方針に迷うことが少なくない.本稿では,この腫瘍に対する治療について述べる.ただし,異型カルチノイドに限定された報告が,あまり検索されなかったため,必然的に定型カルチノイドの情報も交えたものとなっていることをご容赦頂きたい.
II.疫学
全気管支肺カルチノイド切除数は,本邦の胸部外科手術の2017年の統計報告1)では,原発性肺悪性腫瘍44,563例中233例(0.52%)であった.同論文では,TC,AC別の数値はみられなかったが,IASLC第8版TNM病期分類に関する2018年の論文では,全カルチノイド4,645例中4,254例(92%)がTC,391例(8%)がACと,TCに比べてACは極めて少ない2).
III.診断,病理,TNM分類
<病理組織学的特徴>
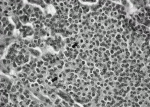
カルチノイドの組織学的特徴は,神経内分泌形態と呼ばれるmolding, organoid pattern, palisading, rosette formationなどの形態を取り,またACにおいては核分裂像が強拡大10視野中で2個以上みられることと定義される(図1).さらに免疫組織学的に神経内分泌マーカーであるクロモグラニンA,シナプトフィジン,NCAM(CD56)が種々に陽性となることである.Swartsらにより,神経内分泌腫瘍の分類が,表1の様に報告されている3).
また近年,肺カルチノイドや高悪性度神経内分泌腫瘍の鑑別に有用な分子マーカーとして,Orthopedic Homeobox Protein(OTP)やKi-67が報告されている.OTPは,胎生期の神経発達時,特に視床下部発達時や神経芽細胞分化の際に働くことが知られている核内転写因子である.OTPの核内発現は,カルチノイド,特にTCにおいて顕著にみられ,高悪性度神経内分泌腫瘍や消化管神経内分泌腫瘍との鑑別に役立つとされる.気管支肺カルチノイドのOTPの核染色陽性の感度80.2%,特異度99.4%と報告されており,有用な診断マーカーであることが示されている4).ACの診断においても,核OTP陽性は,17~83%の感度があったと報告されている5)6).Ki-67陽性率は,細胞増殖能の指標だが,カルチノイドでは10%を超えることは少なく,論文によりcut-off値に若干の差がみられる.
前述の核OTPやCD44,Ki-67などは,予後予測因子としても挙げられており,核OTPやCD44発現は,同じ病期であっても予後良好と報告されている7).Ki-67は種々の癌で予後不良因子として挙げられているが,カルチノイドにおいても,Ki-67陽性であれば,予後不良であることが報告されている8).
<TNM病期分類>
カルチノイドは中枢気管支発生頻度が高いうえに,浸潤転移能が低いため,そのstagingが非小細胞肺癌と同様で良いのかどうかという議論がなされてきた.また組織grade(TC or AC)の違いが予後に独立して関わっていることから,Cattoniらは,通常のTNM分類に加え,組織gradeも考慮した新しい分類を提唱している9).肺癌の第8版TNM分類が公表され,Yoonらは,2018年発表された論文で,その有用性を検討している.SEERデータベースから抽出された気管支肺カルチノイド4,645例について第8版TNM分類に従って再分類した結果,TC4,254例(92%),AC391例(8%),病期分類別の割合はⅠ期65%,Ⅱ期12%,Ⅲ期15%,Ⅳ期8%であった2).391例のACの腫瘍特異的生存率について,各T,N,M因子について有意な差を認めたが,隣り合うstage間では,有意差がみられないものもあった.最終的な10年生存率は,Ⅰ期87.8%,Ⅱ期75.5%,Ⅲ期47.5%,Ⅳ期18.5%であった2).

IV.分子生物学的特徴
気管支肺カルチノイドの遺伝子変化について,RNAseqを用いた全ゲノムシークエンスや全エクソンシークエンスの結果が報告されている.Fernandez-CuestaやSimboloらによるこれらの研究には,それぞれ9例および35例のACが含まれていた.結果は,LCNEC/SCLCと比して遺伝子変異量は少なく,喫煙によるtransversionの頻度も少なかった.有意な変異がみられた遺伝子は,MEN1,E1F1AX,ARID1A,TP53,KMT2C,DSCAML1,KMT2D,NOTCH2,PCLOが挙げられている.中でも,最も高頻度であったのはヒストン修飾因子,腫瘍抑制因子であるMEN1であり,疾患の11~22%でみられた.クロマチンリモデリング関連遺伝子が高頻度に変異していることや,TP53やRB1,ATMなどの腫瘍抑制遺伝子にも多く変異が見つかっていた.PI3K/Akt/mTOR経路での変異,特にPIK3CA遺伝子変異は,特にACで多くみられていた10)11).またカルチノイドの約5%の患者が,生殖細胞系列におけるMEN1遺伝子異常による多発性内分泌腫瘍1型(MEN1)ともいわれている.ACに特徴的な遺伝子変化としては,MEN1,MYCL,SRC,BCL2のamplificationがみられたが,これには,さらなる症例集積による検討が必要と考えられた11).
V.治療,予後
<外科治療>
カルチノイドの基本的治療戦略は,外科的切除が一般的に推奨されている.
Dermawanらは,第8版TNM分類に沿った肺カルチノイド腫瘍の予後因子の解析をおこなっている.188例のTCおよび17例のACを含む205例の完全切除例コホートの無再発生存期間に関する多変量解析では,TCに対するACのオッズ比が最も高かった(OR=13.58,p=0.0006)12).また同様にSEERデータベースから抽出した7,057例のうち503例のACを対象にして,特に病期ごとに層別化した予後予測因子の解析では,regional disease(局所領域症例)においては,縮小手術より有意に葉切除で予後良好であった(p=0.011).また有意ではないもののlocalized disease(局所症例)でも葉切除で予後良好な傾向がみられた(P=0.151)13).これらのことから,ACの遠隔転移が無い症例については,葉切除以上の外科手術が推奨されるものと考えられる.
またリンパ節郭清の必要性についてであるが,全米のNational Cancer Databaseから抽出されたリンパ節郭清が行われた3,335例のカルチノイド症例(TC2,893例,AC442例)の報告では,異型カルチノイド症例での病理学的リンパ節転移症例は,203例(45.9%)でみられた.サイズが大きくなるにつれて,リンパ節転移陽性率が高くなり,2㎝以上では54%で転移がみられ,有意に予後不良であった.またcN0症例の11%の症例で病理学的リンパ節転移が認められた.従って,AC症例では,リンパ節郭清についても必要と考えられる14).
カルチノイド腫瘍は,中枢性気管支内腫瘍である頻度も多く,特にTCでは,経気管支治療も有効とされている.Brokxらは,一次治療として,経気管支治療を行った中枢性気管支カルチノイド全症例の42%が外科切除不要であったが,29例のACにおいては,5例で根治が得られるも残りの24例については,最終的に外科的切除が必要であり,うち3例で肺や肝への転移がみられたと述べている15).手術時期の遅延や経気管支治療後の頻回なHRCTや気管支鏡検査が患者の不利益になりうると指摘している.またReulingらは,154例の気管支カルチノイド(TC135例,AC19例)に対する経気管支治療の成功要因について多変量解析を行っており,腫瘍径15mm以下と完全な気管支内病変であることが,独立した治療成功要因であり,組織型では有意差がみられていなかったと述べられている16).これらの論文から,ACに対する経気管支治療については,認められるものの,かなり限定的であろうと考えられる.
<抗ホルモン受容体治療薬>
カルチノイドは,ホルモン産生性腫瘍としての側面も持ち合わせており,機能性(症候性)腫瘍の場合や腫瘍組織のソマトスタチンレセプター(SSTRs)発現がみられる場合にホルモン治療の適応となる.SSTRタイプ2Aが最も多く発現しているが,タイプ1,3,5発現もみられる.一般的に腫瘍悪性度と逆相関しているとされるが,TCとACでは発現率に有意差はみられない.オクトレオチドPETスキャンとSSTRs染色と相関していると考えられ,非侵襲性バイオマーカーとなりうる.市販されている長時間作用性ソマトスタチンアナログ(SSAs)はSSTR2Aに結合し,その効力を発揮する.近年,非機能性カルチノイドに対するSSAsの抗腫瘍効果も報告され,気管支肺カルチノイドに対する前向き多施設共同第三相ランダム化比較試験(SPINET試験)の結果が期待される.またSSTR2A以外の受容体も標的とする第二世代SSAも開発中であり,特に気管支肺カルチノイドでの有効性が期待される.
またPeptide Receptor Radionuclide Therapy(PRRT)は,放射性物質をソマトスタチン受容体特異的結合ペプチドに結合したものであり,腫瘍内に取り込まれることで,抗腫瘍効果を発揮する.最近の臨床試験の結果では,TCおよびACに対する治療成績として,中央生存期間48.6~58.8カ月と報告されているが,ACに対しては病勢制御率や無病生存期間,全生存期間ともに不良である17).
<分子標的治療薬>
消化管由来腫瘍を含む低悪性度神経内分泌腫瘍に対するエベロリムス(mTOR阻害剤)によるPI3K/Akt/mTOR経路阻害は,第三相ランダム化比較試験が行われており(RADIANT-4試験),全腫瘍389例を対象にした解析で無増悪生存期間が有意に延長していた(中央値11.0カ月 vs 3.9カ月,HR=0.48,p<0.00001).気管支肺カルチノイド90例だけのsubgroup解析にても,有意に良好な治療効果を認めていた18).
その他の標的分子として,VEGFやErbB,ALK,NTRK,IGF-1,CDK4/6などが候補分子として,挙げられている.
<殺細胞性抗癌剤>
気管支肺カルチノイドは,LCNECやSCLCといった高悪性度神経内分泌腫瘍と遺伝子変異の特徴も違い,増殖能も低いことから,従来の殺細胞性抗癌剤による抗腫瘍効果は限定的と考えられるが,一般的には小細胞癌と同様のシスプラチンやエトポシドが多く使用されている.だが,その奏効率は約22%と小細胞癌に比べて著明に低い19).
免疫治療の時代となり,気管支肺カルチノイドでもその有効性が期待されているが,カルチノイドは,そもそも遺伝子変異が少なく,CD8陽性Tリンパ球浸潤やPD-L1発現も少ない,いわゆる“cold tumor”であることから,有効性が低いことが予測される.
<術後補助療法>
ACに対する術後補助療法について,Wegnerらは,National Cancer Databaseからのretrospective viewを行い,533例のⅠ/Ⅱ期症例および129例のⅢ期症例のリスク因子について解析している.術後療法施行群の特徴的な因子としては,Ⅰ/Ⅱ期症例では,断端陽性,リンパ節陽性率(切除リンパ節数における悪性陽性リンパ節数)が1~25%,Ⅱ期,より過去の症例であった.Ⅲ期症例では,女性およびリンパ節陽性率26~50%であった.生存率に対するCox回帰分析による多変量解析では,Ⅰ/Ⅱ期では年齢,合併症スコア高値,断端陽性,リンパ節陽性率高値が,Ⅲ期では治療施設が地方であること,リンパ節陽性率高値が独立した予後不良因子であった.Propensity score matchingによる調整を行った後の予後比較においては,Ⅰ/Ⅱ期症例の5年生存率は,補助療法無し78%,補助療法有り73%(p=0.30)で有意差はみられず,Ⅲ期症例の5年生存率は,補助療法無し57%,補助療法有り50%(p=0.89)とこちらも有意差がみられなかった20).筆者らは,ACに対して,定型的に術後補助療法はすべきではないと結論付けている.また2020年版NCCNガイドラインによれば,異型カルチノイド完全切除例のⅢA期症例の術後補助療法として,CDDPやcarboplatinとetoposideの併用療法やテモゾロミドを加えるべきとの報告もあるが限定的なデータのため,今後の臨床試験によって解明される必要がある.
VI.おわりに
気管支肺カルチノイド,特にACは,生検による診断は困難で,症例数も少なく稀な疾患といえる.高悪性度神経内分泌腫瘍と比較して予後は良好だが,転移能も有しており,積極的な治療が望まれる.増殖能が低いことから,抗癌剤や放射線治療の有効性は限定的であり,外科切除が唯一の標準治療といえる.現在,殺細胞性抗癌剤を含む治療薬で第一選択薬といえるものがなく,特に標準治療薬やmultimodalityな治療戦略の確立が今後の課題である.
利益相反:なし
文献
1) Shimizu H, Okada M, Tangoku A, et al.: Thoracic and cardiovascular surgeries in Japan during 2017:Annual report by the Japanese Association for Thoracic Surgery. Gen Thorac Cardiovasc Surg, 68(4): 414-449, 2020.
2) Yoon JY, Sigel K, Martin J, et al.: Evaluation of the Prognostic Significance of TNM Staging Guidelines in Lung Carcinoid Tumors. J Thorac Oncol, 14(2): 184-192, 2019.
3) Swarts DRA, Ramaekers FCS, Speel EJM.: Molecular and cellular biology of neuroendocrine lung tumors:Evidence for separate biological entities. Biochim Biophys Acta - Rev Cancer, 1826(2): 255-271, 2012.
4) Nonaka D, Papaxoinis G, Mansoor W.: Diagnostic utility of orthopedia homeobox (OTP) in pulmonary carcinoid tumors. Am J Surg Pathol, 40(6): 738-744, 2016.
5) Hanley KZ, Dureau ZJ, Cohen C, et al.: Orthopedia homeobox is preferentially expressed in typical carcinoids of the lung. Cancer Cytopathol, 126(4): 236-242, 2018.
6) Viswanathan K, Borczuk AC, Siddiqui MT.: Orthopedia homeobox protein (OTP) is a sensitive and specific marker for primary pulmonary carcinoid tumors in cytologic and surgical specimens. J Am Soc Cytopathol, 8(1): 39-46, 2019.
7) Papaxoinis G, Nonaka D, O’Brien C, et al.: Prognostic Significance of CD44 and Orthopedia Homeobox Protein (OTP) Expression in Pulmonary Carcinoid Tumours. Endocr Pathol, 28(1): 60-70, 2017.
8) Kasajima A, Konukiewitz B, Oka N, et al.: Clinicopathological profiling of lung carcinoids with a Ki67 Index > 20%. Neuroendocrinology, 108(2): 109-120, 2019.
9) Cattoni M, Vallières E, Brown LM, et al.: Improvement in TNM staging of pulmonary neuroendocrine tumors requires histology and regrouping of tumor size. J Thorac Cardiovasc Surg, 155(1): 405-413, 2018.
10) Fernandez-Cuesta L, Peifer M, Lu X, et al.: Frequent mutations in chromatin-remodelling genes in pulmonary carcinoids. Nat Commun, 5: 3518, 2014.
11) Simbolo M, Mafficini A, Sikora KO, et al.: Lung neuroendocrine tumours:deep sequencing of the four World Health Organization histotypes reveals chromatin-remodelling genes as major players and a prognostic role for TERT, RB1, MEN1 and KMT2D. J Pathol, 241(4): 488-500, 2017.
12) Dermawan JK, Farver CF.: The Prognostic Significance of the 8th Edition TNM Staging of Pulmonary Carcinoid Tumors:A Single Institution Study with Long-term Follow-up. Am J Surg Pathol, 43(9): 1291-1296, 2019.
13) Huang Y, Yang X, Lu T, et al.: Assessment of the prognostic factors in patients with pulmonary carcinoid tumor:a population-based study. Cancer Med, 7(6): 2434-2441, 2018.
14) Kneuertz PJ, Kamel MK, Stiles BM, et al.: Incidence and Prognostic Significance of Carcinoid Lymph Node Metastases. Ann Thorac Surg, 106(4): 981-988, 2018.
15) Brokx HAP, Paul MA, Postmus PE, et al.: Long-term follow-up after first-line bronchoscopic therapy in patients with bronchial carcinoids. Thorax, 70(5): 468-472, 2015.
16) Reuling EMBP, Dickhoff C, Plaisier PW, et al.: Endobronchial treatment for bronchial carcinoid:Patient selection and predictors of outcome. Respiration, 95(4): 220-227, 2018.
17) Ianniello A, Sansovini M, Severi S, et al.: Peptide receptor radionuclide therapy with 177Lu-DOTATATE in advanced bronchial carcinoids:prognostic role of thyroid transcription factor 1 and 18F-FDG PET. Eur J Nucl Med Mol Imaging, 43(6): 1040-1046, 2016.
18) Yao JC, Fazio N, Singh S, et al.: Everolimus for the treatment of advanced, non-functional neuroendocrine tumours of the lung or gastrointestinal tract (RADIANT-4):A randomised, placebo-controlled, phase 3 study. Lancet, 387(10022): 968-977, 2016.
19) Wirth LJ, Carter MR, Jänne PA, et al.: Outcome of patients with pulmonary carcinoid tumors receiving chemotherapy or chemoradiotherapy. Lung Cancer, 44(2): 213-220, 2004.
20) Wegner RE, Abel S, Hasan S, et al.: The role of adjuvant therapy for atypical bronchopulmonary carcinoids. Lung Cancer, 131(March): 90-94, 2019.
PDFを閲覧するためには Adobe Reader が必要です。