日外会誌. 122(1): 10-17, 2021
特集
肺・胸腺神経内分泌腫瘍の治療
2.神経内分泌腫瘍における細胞診の役割―治療前診断を中心に―
|
北里大学医学部 呼吸器外科学 佐藤 之俊 |
胸部の悪性腫瘍診療領域において画像診断は急速に進歩しているが,組織型の決定や分子生物学的検索には細胞あるいは組織学的アプローチが必要である.肺・胸腺の神経内分泌腫瘍は,4カテゴリーに分類されている.すなわち,定型カルチノイド,異型カルチノイド,大細胞神経内分泌癌,そして小細胞癌である.一般に,低悪性度で切除可能なときは外科手術が選択され,高悪性度の中でも小細胞癌は化学放射線療法が選択される場合が多い.そのため治療前診断が重要であるが,組織生検の困難な肺末梢病変や縦隔病変では,診断に細胞診が有用である.細胞診が最も有用なのは小細胞癌の診断である.大細胞神経内分泌癌も近年細胞診断基準が普及してきたが,小細胞癌との鑑別が最も難しい.肺・胸腺の神経内分泌腫瘍に関しても,細胞診の適切な利用によって臨床的有用性が発揮できる.
キーワード
肺, 胸腺, 神経内分泌腫瘍, 診断, 細胞診
I.はじめに
肺癌をはじめとする悪性腫瘍は,組織型により治療法の選択,経過,予後が異なる.近年,肺癌診療における画像診断は急速に進歩しているが,組織型の決定や分子生物学的検索には細胞組織学的アプローチが必要である.肺は組織診が困難な臓器の一つであり,種々の診断手技を用いて癌細胞を検出する細胞診が最終診断となる場合が多い.現在肺癌の病理細胞診診断は,WHO分類第4版と肺癌取扱い規約に準拠して進められているが,このWHO分類第4版では,腺癌に多段階発がんの概念が取り入れられたこと,大細胞癌から神経内分泌腫瘍の項目が独立したこと,さらに,従来は形態を重視した分類であったが,分子標的薬の出現に伴い免疫染色を用いて積極的に分類することが求められていること,などが特徴である1)2).
本項では,肺ならびに胸腺の神経内分泌腫瘍に対する治療前診断における細胞診の役割について述べたい.
II.肺と胸腺の神経内分泌腫瘍について
現在,肺の神経内分泌腫瘍は次の4カテゴリーに分類されている.すなわち,定型カルチノイド[typical carcinoid(TC)],異型カルチノイド[atypical carcinoid(AC)](図1),大細胞神経内分泌癌[large cell neuroendocrine carcinoma(LCNEC)],そして小細胞癌[small cell lung cancer(SCLC)]である.これらの定義(診断基準)を表1に示す.それぞれの組織型の肺腫瘍における頻度はTC 1~2%,AC 0.2%以下,LCNEC 2~3%,そしてSCLC 10~15%と言われている.重要なのは,消化器系の神経内分泌腫瘍の分類とは異なっている点を理解している必要があることである1)
~
3).
一方,胸腺では上皮性腫瘍の約3%が神経内分泌腫瘍である.神経内分泌細胞がほとんどを占める胸腺上皮性腫瘍を指す.胸腺の神経内分泌腫瘍は,肺原発と同様に4組織型に分類されている.WHO分類では,定型的カルチノイドと非定型的(異型ではなく)カルチノイドを高分化型神経内分泌癌,大細胞神経内分泌癌と小細胞癌を低分化型神経内分泌癌としてまとめている4).注意すべき点は,胸腺腫や胸腺癌の部分像として神経内分泌腫瘍成分を混じている場合は「混合性胸腺上皮性腫瘍」に含める点である.すなわち,胸腺腫,胸腺癌,胸腺神経内分泌腫瘍のそれぞれの組織型のうち,二つ以上の組織型成分がそれぞれ明確な領域を示すものを混合性胸腺上皮性腫瘍という.神経内分泌腫瘍を含むものでは,カルチノイドや小細胞癌と他の組織亜型との組み合わせの頻度が高い4).


III.治療について
各腫瘍の治療の詳細は他項に譲るが,総論的な内容を述べる.
1.カルチノイドの治療
肺気管支・胸腺カルチノイドは患者数が少ないために,肺癌のようなエビデンスが十分とはいえず,経験に基づく治療も多い.一般に,切除可能な場合は外科手術,局所進行性では(転移は少ないが,切除することが周囲臓器との関係から不可能な場合)は根治的放射線治療,また,転移病変がある場合は全身治療となる5).
全身治療(内科的治療)の場合には,比較的進行の遅い症例にはエベロリムスやソマトスタチンアナログ,早い場合には細胞障害性抗がん薬の治療が行われる.診断は病理によるが,進行の速度もある程度予想はできるものの,組織像が同じであっても患者ごとに進行の程度が異なることも多い.有効な治療法は,病理診断に基づいて判断されることが原則であるが,進行が比較的遅いACであっても,急速に進行する例もある.このような場合には,ACとしてエベロリムスやソマトスタチンアナログによる治療が原則であっても,細胞障害性抗がん薬による治療も選択肢となる可能性がある5).
2.肺神経内分泌癌(LCNEC,SCLC)の治療
肺SCLCは,発見時に既に転移をきたしていることが多く,治療の中心は薬物療法,すなわち全身治療である.限局型に対してはEP療法と胸部放射線治療が,進展型に対してはシスプラチン+イリノテカン併用療法(IP療法)やEP療法が施行されるが,初回治療後の再発率はきわめて高い5).LCNECの薬物療法については,エビデンスレベルの高い研究が少ないが,SCLCに準じてプラチナベースの化学療法が施行されている.手術可能症例では,手術前または術後に化学療法を加えることで,予後が改善されるとの報告がある6)7).進行LCNECでは,EP療法の有効性を検討した前向き研究においてSCLCと同程度の成績が示されている一方で8),IP療法ではSCLCにやや劣るとの報告もある9).
このように,神経内分泌腫瘍においても非小細胞癌と同様に,組織型によって選択される治療が異なることを理解し,治療前検査を進めることが必要である5).
IV.細胞診断
1.肺
まず肺腫瘍に関しては,細胞診が診断にとくに有用なのはSCLCであり,診断確定に重要な位置を占めている.SCLCの診断は,光学顕微鏡で行われ,電子顕微鏡や免疫染色による神経内分泌への分化の証明は必ずしも必要とされない.典型例では本症の診断は比較的容易であるが,約28%に非小細胞癌成分が混在することが知られており注意が必要である.SCLCにおいて,電子顕微鏡的に神経内分泌顆粒が認められるのは約3分の2で,免疫染色で神経内分泌マーカーに陽性を示すのは約75%である10)11).
近年,細胞診検体は直接採取法の穿刺や擦過などにより,病変部から細胞を直接採取する方法が主流である.これに対して,肺がん検診では剥離細胞診である喀痰細胞診を高危険度群に行っている2).喀痰細胞診は中枢発生の肺癌,病変が中枢に及んでいるもの,あるいは中枢の早期病変の発見に有用である.扁平上皮癌やSCLCは中枢発生肺癌の代表であり,さらにカルチノイドも比較的太い気管支に発生する.扁平上皮癌やSCLCは喀痰にしばしば腫瘍細胞が出現するが,カルチノイドでは稀である.SCLCの喀痰細胞診では,小型の異型細胞が緩い結合性を有してシート状に配列する.隣接する腫瘍細胞が相互に鋳型状に接する所見がみられる.粘液の中にごく少数の腫瘍細胞が出現する場合もあり注意が必要である2)10)12).
LCNECはSCLCとの鑑別が最も難しいとされる.本腫瘍の特徴は一般に,腫瘍細胞の大きさが小リンパ球の3倍以上を示し,核クロマチンは細顆粒状から粗で,明瞭な核小体を有することなどである.典型例ではSCLCとの鑑別は容易であるといえるが,SCLCや低分化癌との細胞所見に多くの類似性が認められ,鑑別が困難であることが知られている.この鑑別には免疫染色が有効とはいえず,形態学的に結合性の強い大型の細胞集塊の出現と核小体の不明瞭な小型細胞の出現が鑑別の重要なキーポイントとなる.すなわち,前者はLCNEC,後者はSCLCに特徴的な細胞所見といえる.さらに,低分化腺癌や低分化扁平上皮癌もLCNECとの鑑別に難渋することがある2)12)13).
われわれは,LCNECとSCLCの通常の細胞診所見をもとに細胞学的判別モデルを作成し評価したので紹介する14).まず,パパニコロウ染色による細胞形態で差のあった所見としては,①腫瘍細胞の出現形式(LCNECでは集塊が,SCLCでは散在性が優位),②細胞集塊(LCNECは大型で結合性の強い集塊の出現が目立つ),③細胞配列(LCNECは柵状配列が目立つ),④腫瘍細胞の平均面積(LCNEC[178.1 μm2]がSCLC[127.2 μm2]より大型),⑤核(LCNECは裸核が目立つ)であった.これらのうち,強い結合性を示す大型集塊の出現頻度と,核小体の目立たない小型細胞の出現頻度という2因子に有意な差を認めた.この2因子に対し,ロジスティック判別分析を用いて判別直線を算出し検討したところ,誤判定率5%で大細胞神経内分泌癌と小細胞癌を鑑別することが可能であった.すなわち,強い結合性を示す大型集塊の出現頻度と,核小体の目立たない小型細胞の出現頻度の2因子を用いた細胞学的判別モデルはLCNECとSCLCの細胞学的鑑別に有用であり,通常の細胞診業務の範囲内であっても両者の鑑別を行うことが可能であると考えられた14).
カルチノイドの細胞診については,まず,TCでは前述のように喀痰中に腫瘍細胞を認めることはなく,腫瘍から直接細胞を採取する必要がある.小型で均一な細胞が平面的に配列し,ロゼット様配列が散見される.核クロマチンがゴマ塩状なのが特徴的である.細胞診による本腫瘍の診断は比較的容易である,典型的な細胞像が肺癌取扱い規約に記載されているので参照して頂きたい2).これに対して,ACでは,細胞異型が増しており,核形の不整や核の大小不同がみられる.核分裂像や壊死が認められることもあるが,本腫瘍の診断基準が,病理組織学的に,壊死があり核分裂像が2mm2(または高倍率10視野)あたり2個から10個という定義のため,細胞診では疑うことはできても確定診断は困難である(図1,表1).とくに,LCNECとの鑑別診断は定義上難しいといえる.
2.胸腺
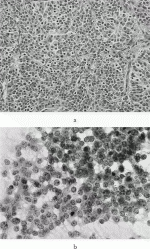
胸腺神経内分泌腫瘍の細胞診であるが,胸腺に対する細胞診の利用は,経皮的穿刺吸引細胞診が最も想定される.胸腺神経内分泌腫瘍の細胞像は,肺癌に準ずる.ただし,穿刺細胞診は,病変のごく一部から検体が採取されるため,混合性胸腺上皮性腫瘍を含め正確な診断確定は困難と思われる4).図2に胸腺原発のLCNEC症例を示す.肺と同様の組織像と細胞像が観察される.


V.遺伝子変異検索のための細胞診検体処理
進行非小細胞肺癌においては,チロシンキナーゼ阻害薬や免疫チェックポイント阻害薬が治療薬の一つとして選択される.適応判定のためには癌細胞を標的とした検査が必要であり,組織検体が十分採取できない場合,あるいは低侵襲性に検体を採取するためには細胞診検体の利用が有効である.神経内分泌腫瘍の鑑別において遺伝子変異を検索する機会は少ないと考えられるが,一般に細胞検体は遺伝子検索に適しているといえる15)16).この場合,細胞の固定法が重要であり,良質のDNAやRNAを効率よく抽出することができるような対応が求められる.とくにアルコール固定はDNAの保存に優れている.その他,セルブロックを用いる方法や液状化細胞診検体を用いる方法等があるが,いずれも推奨されるプロトコールを用いた解析が精度管理上強く求められる16).
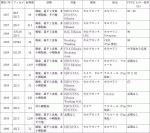
さらに,近年免疫チェックポイント阻害薬選択の手段としてPD-1/PD-L1の検索も行われる.参考として表2に細胞診検体を用いたPD-L1検索についてまとめたので利用して頂けると幸いである.
VI.呼吸器細胞診の報告様式
日本における呼吸器細胞診の報告は肺癌取扱い規約に拠って行われる2).その判定基準は,陰性,疑陽性,陽性の3カテゴリーである.しかし,いまだにパパニコロウのClass分類(Ⅰ,Ⅱ,Ⅲ,Ⅳ,Ⅴ)を用いている施設もあり,その上,呼吸器細胞診の報告様式に関する国際基準はないのが現状である.これに対し,2019年から国際細胞学会が主体となり,日本臨床細胞学会,日本肺癌学会,米国パパニコロウ協会,世界肺癌学会,欧州細胞学会などが中心となって,呼吸器細胞診の国際基準の策定作業が開始された.この事業の開始前の2018年には,日本臨床細胞学会と日本肺癌学会の合同ワーキンググループが組織され報告様式の見直しを行い,表3に示すような提案を行った17).現在,より臨床に即し治療に反映されるような分類の構築作業がInternational Academy of Cytology(IAC)とInternational Agency for Research on Cancer(IARC)によって進められている.

VII.おわりに
肺癌診療においては,近年circulating tumor DNAを用いたliquid biopsyが非侵襲性でありリアルタイムの,かつ個体全体の遺伝子異常を反映する新規の臨床検査として広まっている18).しかし,その限界も指摘されており,腫瘍細胞そのものを低侵襲性に採取し,遺伝子などの解析が可能な細胞診は今後もその存在感を高めていくものと期待される.いずれにせよ,細胞診の適切な利用によって臨床的有用性が発揮できることを強調したい.
利益相反:なし
文献
1) Travis WD, Brambilla E, Burke A, et al.: WHO classification of tumours of the lung, pleura, thymus and heart, 4th edn. International Agency for Research on Cancer, Lyon, 2015.
2) 日本肺癌学会編:臨床・病理 肺癌取扱い規約.第8版,金原出版,東京,2016.
3) Iyoda A, Azuma Y, Sano A: Neuroendocrine tumors of the lung:clinicopathological and molecular features. Surg Today, 2020 Mar 19. doi:10.1007/s00595-020-01988-7. [Epub ahead of print] Review.
4) 日本胸腺研究会編:臨床・病理 縦隔腫瘍取扱い規約.第1版,金原出版,東京,2009.
5) 後藤 悌,元井 紀子:肺・縦隔発生の神経内分泌腫瘍:病理診断と治療Update.肺癌,59: 37-45, 2019.
6) Iyoda A, Hiroshima K, Moriya Y, et al.: Prospective study of adjuvant chemotherapy for pulmonary large cell neuroendocrine carcinoma. Ann Thorac Surg, 82: 1802-1807, 2006.
7) Saji H, Tsuboi M, Matsubayashi J, et al.: Clinical response of large cell neuroendocrine carcinoma of the lung to perioperative adjuvant chemotherapy. Anticancer Drugs, 21: 89-93, 2010.
8) Le Treut J, Sault MC, Lena H, et al.: Multicentre phase II study of cisplatin-etoposide chemotherapy for advanced large cell neuroendocrine lung carcinoma:the GFPC 0302 study. Ann Oncol, 24: 1548-1552, 2013.
9) Niho S, Kenmotsu H, Sekine I, et al.: Combination chemotherapy with irinotecan and cisplatin for large-cell neuroendocrine carcinoma of the lung:a multicenter phase II study. J Thorac Oncol, 8: 980-984, 2013.
10) 日本臨床細胞学会編:細胞診ガイドライン4 呼吸器・胸腺・体腔液・リンパ節.金原出版,東京,2015.
11) 蔦 幸治:高悪性度神経内分泌腫瘍(大細胞神経内分泌癌ならびに小細胞癌)の診断に有用な免疫細胞化学.日臨細胞誌,47(2): 146-147, 2008.
12) 三浦 弘之:肺小細胞癌を鑑別すべき細胞像.日臨細胞誌,47: 144-145, 2008.
13) Hiroshima K, Abe S, Ebihara Y, et al.: Cytological characteristics of pulmonary large cell neuroendocrine carcinoma. Lung Cancer, 48: 331-337, 2005.
14) Hoshi R, Furuta N, Horai T, et al.: Discriminant Model for Cytologic Distinction of Large Cell Neuroendocrine Carcinoma from Small Cell Carcinoma of the Lung. J Thorac Oncol, 5: 472-478, 2010.
15) Matsuo Y, Yoshida T, Yamashita K, et al.: Reducing DNA damage by formaldehyde in liquid-based cytology preservation solutions to enable the molecular testing of lung cancer specimens. Cancer Cytopathol, 126: 1011-1021, 2018.
16) Tanaka R, Ohtsuka K, Ogura W, et al.: Subtyping and EGFR mutation testing from blocks of cytological materials, based on liquid-based cytology for lung cancer at bronchoscopic examinations. Diagn Cytopathol, 48: 516-523, 2020.
17) Hiroshima K, Yoshizawa A, Takenaka A, et al.: Cytology reporting system for lung cancer from Japan Lung Cancer Society and Japanese Society of Clinical Cytology:An interobserver reproducibility study and risk of malignancy evaluation on cytology specimens. Acta Cytol, 64: 452-462, 2020.
18) 荒金 尚子:肺癌におけるLiquid biopsyの意義.肺癌,60: 67-73, 2020.
PDFを閲覧するためには Adobe Reader が必要です。