日外会誌. 121(6): 606-612, 2020
特集
ECMO,補助循環装置の進歩
7.新しい経皮循環補助装置―心内留置型カテーテルポンプ―
|
大阪大学 心臓血管外科 戸田 宏一 , 澤 芳樹 |
薬物療法抵抗性の心原性ショックに対しては,IABPやPCPS等の経皮補助循環装置が用いられてきたが,既存の補助循環装置では血行動態の改善と心筋の負荷軽減を同時に,且つ低侵襲に行うことは難しく,それらを実現できるデバイスとして左心室から大動脈へ直接血液を送り出す経皮的左心補助人工心臓Impellaが開発された.Impellaはカテーテルの先端に小型の軸流ポンプが付いており,大腿動脈,腋窩動脈または直接大動脈から挿入し大動脈弁を跨ぐように留置し,左室から脱血し上行大動脈に送血でき,経皮的LVADと言える.欧米で10万例を越える症例に用いられ,本邦でも2017年10月より心原性ショックに対して保険適応となった.われわれの施設でのImpella 5.0の補助期間は平均17±8日で,挿入後の心拍出量は平均5.8±1.1L/minと十分な循環補助ができ,肺水腫-臓器不全からの回復を認めた.2020年5月の時点で177施設が補助人工心臓治療関連学会協議会インペラ部会によってインペラ認定施設として認定され,1,800例を越える症例に使われ離脱生存率も78%と高い.特に補助効果の高いImpella 5.0の装着・管理における心臓血管外科医の役割は大きく,手技や管理方法に精通することにより重症心不全急性増悪,急性心筋梗塞,劇症型心筋炎,開心術後に伴う心原性ショック症例の救命に寄与することが期待される.
キーワード
心原性ショック, Impella, 補助循環
I.はじめに
薬物療法抵抗性の心原性ショックに対しては,IABPやPCPS等の経皮補助循環装置が用いられてきたが,過去30年間で経皮補助循環装置における新しいテクノロジーは出現しておらず,治療の選択肢は限られていた.既存の補助循環装置では血行動態の改善と心筋の負荷軽減を同時に,且つ低侵襲に行うことは難しく,それらを実現できるデバイスとして左心室から大動脈へ直接血液を送り出す経皮的左心補助人工心臓Impellaが開発された.
II.Impellaとは
Impellaはカテーテルの先端に小型の軸流ポンプが付いており,大腿動脈,腋窩動脈または直接大動脈から挿入し大動脈弁を跨ぐように留置し,左室から脱血し上行大動脈に送血する補助循環用カテーテルポンプである(図1).循環補助の原理としては左室補助人工心臓(LVAD)とほぼ同じであり,経皮的LVADと言える.欧米で10万例を越える症例に用いられ,その安全性と効果が確認され,本邦でも2017年10月より使用可能となった1).現在本邦では,最大2.5L/minの流量補助ができるImpella 2.5,最大3.7L/minの流量補助ができるImpella CPと,最大5.0L/minの流量補助ができるImpella 5.0が使用可能である.Impella留置には開胸は不要であり身体への侵襲性が低い.カテーテルの最も太い軸流ポンプ部分はImpella 2.5で12Fr,Impella CPで14Fr Impella 5.0で21Frであり,前2者は穿刺にて挿入が可能であり,カテーテル室などで緊急使用が可能である.Impella 5.0では8~10mmの人工血管を大腿動脈または腋窩動脈に吻合して挿入する.
適応としては,欧米では心原性ショック症例のみならず,冠血行再建中の補助循環(supported PCI)として使われるが,supported PCIの有用性を示すエビデンスが本邦承認時では少なく,現在心原性ショックのみが保険適応となっている.2020年5月の時点で177施設が補助人工心臓治療関連学会協議会インペラ部会によってインペラ認定施設として認定され,1,800例を越える症例に使われている.全ての使用症例はレジストリーに登録することが義務化されており,447例をまとめた初期のレジストリーデータではインペラ単独のサポートを要した232例の内182例(78.4%)がインペラ離脱後30日以上生存していた.インペラの適応疾患が院内死亡率50%の心原性ショックであることを考えるとショック患者の救命率向上に寄与していると言えよう.
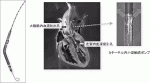
III.Impellaの効果
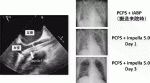
心原性ショックに対するImpellaの効果は二つあり,①流量補助による臓器潅流不全の改善,②左室内圧を下げることによる心筋負荷軽減・心機能回復.この②がPCPSにない利点であり,経皮的LVADと言われる所以である.急性心筋梗塞モデルにおいては,再灌流前からImpellaでフルサポートすることにより心筋梗塞後4週間における心筋梗塞範囲が16.3±2.6%から2.1±1.6%に減少し,左室拡張末期圧も15.0±3.5mmHgから4.7±1.7mmHgに減少することが示されている2).①の流量補助に関しては,Impella 5.0で循環補助した58例の検討ではcardiac indexは1.8±0.6L/min/m2から2.8±0.6L/min/m2に改善した3).われわれの施設での初期9例のIMPELLA 5.0の補助期間は平均17±8日で,挿入後の心拍出量は平均5.8±1.1L/minと十分な循環補助ができ4),肺水腫-臓器不全からの回復を認めた(図2).
臨床的効果に関してはAMIショックに対する効果をIABPとRCTで比較したものが二つあるが,症例数が少なく差は見出されていない5)6).劇症型心筋炎に対する効果は欧米の多施設研究において34例に使用され内21人(62%)が生存退院できている7).開心術後ショック症例に関してはImpella 5.0の効果が前向き多施設研究で調べられている8).16例中6例(38%)で再開胸止血術を要したが,早期死亡1例,14例で離脱,1例で植込み型LVADへ移行し,3カ月,1年生存率は各々81%,75%であった.一方,重症心不全に対するブリッジとしてのImpella 5.0の効果は58症例の多施設研究では1/4が心臓移植へ,1/3が植込み型LVADへと移行し,サポート中の合併症としては,脳合併症は無いが出血性合併症が21%で認められている3).
IV.Impellaの挿入,抜去,入れ替え
1)穿刺で行う挿入方法
主にデバイスが細いImpella 2.5, Impella CPに用いられる.通常の方法で大腿動脈を穿刺しワイヤーを進めた後に,dilator等を用いてシースイントロデューサーを挿入する.このシースからPig tailカテーテル,ワイヤ,デバイス本体を挿入し,位置決めを透視下に行う.
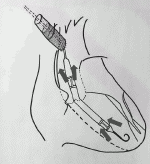
2)人工血管を介して腋窩動脈,大腿動脈から挿入する方法(図3)
デバイスの最大径(ポンプ部分)が21Fr(7mm)のImpella 5.0を挿入する場合等に用いる.人工血管の吻合場所の決定には多くの場合CTが用いられ,吻合予定血管径が7mmありデバイスが通過する血管系に大きなプラークや石灰化が無い所を選択する.3cm程血管を剥離し全身にヘパリン5,000単位投与,周囲に塩酸パパべリンを散布した後にその末梢,中枢に2重に回したvessel loopをかけ軽く引き上げ動脈を15mmほど開ける.ここに斜めに切った8~10mmの人工血管(20cm)を吻合する.Vessel loopを引き上げる事で深い血管の視野が改善する.人工血管の端にAxillary kitを接続しクリップで固定したら,Axillary kitからPig tailカテーテル,ワイヤを挿入し透視下に位置決めを行い,人工血管吻合部直上をクランプで遮断し,Impellaをワイヤガイド下に先ず20cmの人工血管内に挿入する(図3b).次にクランプを外して人工血管越しにImpella本体をつかみ人工血管吻合部を通過させる.Impellaのセンサー部分(図3a)を傷つけないように押し込む必要がある.Impellaが適切な位置に入り,駆動に問題ない事を確認できたら,人工血管吻合部直上でImpellaのカテーテルとともに人工血管を柔らかいクランプで遮断し(図3c),Axillary kitを除去し20cmの人工血管を皮下に収まる程度(3~4cm程)に短切する.次に血管の末梢,中枢に回してあるvessel loopを引き上げ出血をコントロールし,留置用シースを人工血管-動脈吻合部を越えて血管内に挿入し,シースストッパーを人工血管に固定する(図3d).留置用シースを皮膚に固定し,閉創する(図3e).なお,後で述べるImpella抜去や,交換の時に有用であるので,われわれはvessel loopは緩めた状態で必ず創部に残して閉創している.
3)開胸して挿入する方法(図4)
右第二肋間開胸,upper hemi-sternotomy,または通常の胸骨正中切開で大動脈弁から8cm末梢側の上行大動脈を部分遮断する.ここに径6mmの穴をあけ,10mmの人工血管を吻合する.Axillary kitを用いてImpellaを挿入し,適切な位置に入り駆動に問題ない事が確認されたら,吻合部直上をソウフトジョウクランプで遮断し,人工血管を短切し,断端から備え付けのプラグをカテーテル周囲に挿入し人工血管大動脈吻合部まで押し込む.人工血管の外側から結紮することで,プラグが大動脈の吻合部を覆うように入り,出血のみならず,人工血管盲端部の血栓形成を防ぐ.ただし,この方法では閉胸後の位置調整は難しく,Impella抜去する場合は再開胸する必要がある.
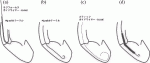
4)Impellaの左室内への誘導・ワイヤー操作(図5)
透視下にラジフォーカスガイドワイヤー(0.035)を用いてPig tailカテーテルを左室心尖部に誘導する.ガイドワイヤを先行させると大動脈弁を傷つけたり,ワイヤが僧帽弁腱索の間に迷入して僧帽弁を傷つける可能性があるのでPig tailカテーテルを先行させる(図5a,b).またPig tailカテーテルが僧帽弁腱索などに引っ掛かっていることが疑われる場合は,Pig tailカテーテルを動かせて僧帽弁逆流の増悪をみないか確認する.Pig tailカテーテルが適切に心尖部に留置されたら,ガイドワイヤーを附属のスティッフガイドワイヤー(0.018)へ入れ替えPig tailカテーテルを抜去する.この時ワイヤの柔らかいところが心尖部に大きく弧を描き数字の“6”の様な形で入っていることを確認する(図5c).このワイヤをImpellaカテーテルの先端から挿入し,ポンプ吐出孔から出しカテーテルの黒線に沿わして配置し,Axillary kitを接続した人工血管に挿入する(図3).先端が心尖方向へ向くように調整し,X線または心臓超音波検査によって留置位置を決定する.血液吸入部が大動脈弁から35±2mmに位置するのが良いと言われており,透視,心エコーで確認する(図5d).スティッフガイドワイヤーを抜去し,速やかにImpellaによる循環補助を開始する(駆動開始しないと大動脈内血液がカテーテルポンプを通って左室内へ逆流する).Axillary kitを除去し,附属の留置用シースで固定する(図3d,e).補助レベルをあげるとImpellaが移動することがあるので,段階的にP-9のレベルまで補助レベルをあげて位置がずれない事を確認する.位置が決まれば滅菌スリーブを留置用シースに固定リングを回して固定しカテーテルが動かない事を確認する(図3f).
5)Impellaの抜去
P-1レベルに下げてImpellaを左室から大動脈内に引き戻し,P-0レベルに下げた後に残しておいたvessel loopの動脈末梢側を締めておいて,血液を吹かせながらImpellaを抜去する.中枢側のvessel loopも締めて出血をコントロールし,残存した人工血管を吻合部1cm上まで除去し,腋窩動脈内に血栓無い事確認し残存人工血管を縫合閉鎖する.
6)Impellaの入れ替え
Impellaの耐久性に関しては,本邦の承認書上では使用期間は明示されていないが,欧州のCEマークではImpella 2.5は5日間,Impella 5.0は10日間までの使用が想定されており,これらを超えてサポートが必要な場合は交換を考慮する必要がある.またパージ流量の減少が進む症例,ポンプの消費電力が上昇する症例もポンプ交換を検討する.ただし,交換にはPCPS等の補助循環を要する事も多くリスクもあり,交換のタイミングは臨床的判断を要する.手技は抜去と同様に開創し,中枢と末梢のvessel loopで出血をコントロールしImpella抜去する.腋窩動脈,人工血管内に血栓無い事確認し,人工血管断端に新たに8~10mmの人工血管(20cm)を吻合する.ここにAxillary kitを接続し上述した方法で新しいImpellaを入れる.或いは,他の血管からのアプローチが可能な場合は,古いImpellaでサポートしつつ新たに人工血管を吻合し,古いImpella 抜去後に,Pig tailを左室内に挿入し,新たなImpella をワイヤ越しに挿入する.

V.Impellaの管理
循環補助中は血行動態を観察しながら補助レベルを調整する.Impellaは左心補助装置であるので,適切な左心還流が必要である.そのためには右心の管理が重要で,輸液輸血による適切な前負荷,強心剤による右心収縮補助,肺血管抵抗を下げることによる右心後負荷の軽減,タンポナーデの解除等による右心拡張不全の改善が必要となる.また肺不全,右心不全が強い場合は,PCPS を併用する.肺,右心機能が回復してくれば徐々にPCPSによる循環補助を下げていき,最終的にPCPSを先に離脱しImpellaのみによる循環補助に移行することも出来る.国内症例の約半数はこの様にPCPSとの併用で使われている.
自己心機能の回復,Impellaのポンプ回転数の変化によって,ポンプカテーテルは移動しうるので,附属のモニター,心エコーや胸部レントゲンで留置位置が適切に維持されているか確認し,必要あれば位置調整を行う.特に大腿から入れた場合は動きやすいので注意が必要である.カテーテル内で小型軸流ポンプは毎分3万~5万回転しており,発熱などからのダメージを防ぐためにポンプ内にヘパリン化デキストロース液(パージ液)を流しておりこれを止めてはならない.Impella駆動開始後は一旦ヘパリンはプロタミンで完全中和するが,ICU帰室後に出血が落ち着いた時点でヘパリン持続全身投与を行いACTは160〜180秒で管理する.ただしパージ液中にもヘパリンが入っているため投与総量に注意が必要である.海外の報告にもあるように出血性合併症は稀ではなく,われわれの施設では症例に分けてパージ液のプロトコールを作成している4).またポンプ流量,圧波形,パージ流量等はインペラコネクトにweb上でlog-inする事によって在宅でモニターすることも出来るようになっている(図6).

VI.おわりに
低侵襲に装着可能な,LVAD並みに強力な経皮補助循環により多くの心原性ショック症例の救命が期待される.
利益相反:なし
文献
1) Yoshida S, Toda K, Miyagawa S, et al.: Impella 5.0 as a Bridge to Implantable Left Ventricular Assist Device - First Clinical Case in Japan. Circ J, 82(11): 2923-2924, 2018.
2) Saku K, Kakino T, Arimura T, et al.: Left Ventricular Mechanical Unloading by Total Support of Impella in Myocardial Infarction Reduces Infarct Size, Preserves Left Ventricular Function, and Prevents Subsequent Heart Failure in Dogs. Circ Heart Fail, 11(5):e004397, 2018.
3) Hall SA, Uriel N, Carey SA, et al.: Use of a percutaneous temporary circulatory support device as a bridge to decision during acute decompensation of advanced heart failure. J Heart Lung Transplant, 37(1): 100-106, 2018.
4) Toda K, Sawa Y: Intraaortic Balloon Pumping(IABP) and Impella. Kyobu Geka, 71(10): 821-826, 2018.
5) Seyfarth M, Sibbing D, Bauer I, et al.: A randomized clinical trial to evaluate the safety and efficacy of a percutaneous left ventricular assist device versus intra-aortic balloon pumping for treatment of cardiogenic shock caused by myocardial infarction. J Am Coll Cardiol, 52(19): 1584-1588, 2008.
6) Ouweneel DM, Eriksen E, Sjauw KD, et al.: Percutaneous Mechanical Circulatory Support Versus Intra-Aortic Balloon Pump in Cardiogenic Shock After Acute Myocardial Infarction. J Am Coll Cardiol, 69(3): 278-287, 2017.
7) Annamalai SK, Esposito ML, Jorde L, et al.: The Impella Microaxial Flow Catheter Is Safe and Effective for Treatment of Myocarditis Complicated by Cardiogenic Shock: An Analysis From the Global cVAD Registry. J Card Fail, 24(10): 706-710, 2018.
8) Griffith BP, Anderson MB, Samuels LE, et al.: The RECOVER I: a multicenter prospective study of Impella 5.0/LD for postcardiotomy circulatory support. J Thorac Cardiovasc Surg, 145(2): 548-554, 2013.
PDFを閲覧するためには Adobe Reader が必要です。