日外会誌. 121(6): 594-599, 2020
特集
ECMO,補助循環装置の進歩
5.急性心不全におけるECMO治療の実際とその位置づけ
|
九州大学病院 心臓血管外科 牛島 智基 , 塩瀬 明 |
急性心不全の患者数は増加の一途である.心不全治療は大きく進歩を遂げてきてはいるものの,急性心不全患者の予後はいまだ不良であり,われわれが克服すべき課題であることは今も昔も変わらない.
血行動態が極めて不安定な薬物治療抵抗性の心原性ショックや低灌流性心不全の場合に,機械的補助循環の使用が考慮される.体外式膜型人工肺(ECMO, Extracorporeal membrane oxygenation)はその第一選択として選択されるデバイスの一つである.種々のデバイスから適切な機械的補助循環を選択するためには,疾患の重症度と適切な病態の把握が重要である.デバイスの特性と問題点を十分に理解し,最適の管理を行うことが治療成功のカギである.
さらに近年では,ECMOは,急性心原性ショックからの回復を目指す急性期治療(Bridge to Recovery)に加え,心臓移植を含めた重症心不全治療の一翼を担う役割(Bridge to Bridge)も果たしており,心不全治療における重要性がより一層高まっていると言える.
本稿では,急性心不全治療におけるECMOの果たす役割について記したい.
キーワード
Extracorporeal membrane oxygenation(ECMO), 急性心不全, 心原性ショック, 経皮的心肺補助法, 機械的循環補助
I.はじめに
急性心不全とは,「心臓の構造的および/あるいは機能的異常が生じることで,心ポンプ機能が低下し,心室の血液充満や心室から末梢への血液の駆出が障害されることで,種々の症状・徴候が複合された症候群が急性に出現あるいは悪化した病態」であると定義されている.日本循環器学会の循環器疾患診療実態調査(JROAD)報告書によると,急性心不全の患者数は年々増加し続けており,2019年度には13万人を超えた1).わが国ばかりでなく,世界的に人口の高齢化や生活習慣病の増加に伴い,心不全患者は増加の一途である.心不全治療そのものは大きく進歩を遂げてきたが,急性心不全患者の予後はいまだ極めて不良であり,急性心不全はわれわれが克服すべき課題であることは今も昔も変わらない.
原因疾患は多岐にわたるが,主たる病態は急性肺水腫(肺うっ血),全身的な体液貯留(溢水),低心拍出による低灌流(心原性ショックを含む)の三つに集約される.急速に心原性ショックや心肺停止に陥る可能性がある逼迫した状態であり,循環動態と呼吸状態の安定化を図るために,適切な病態把握と迅速な治療開始が,治療予後を左右する.急性心不全の診断の詳細は他書に譲るが,日本循環器学会/日本心不全学会合同ガイドライン:急性・慢性心不全診療ガイドラインも参照されたい2).
血行動態が極めて不安定な薬物治療抵抗性の心原性ショックや低灌流性心不全の場合に,機械的補助循環(MCS, Mechanical Circulatory Support)の使用が考慮される.多くの場合,その簡便性から大動脈バルーンパンピング(IABP, Intra-aortic balloon pumping)や体外式膜型人工肺(ECMO, Extracorporeal membrane oxygenation)が,MCSの第一選択と使用される.近年では,補助循環用ポンプカテーテル(インペラ,Impella®,Abiomed, Inc)の臨床導入により,急性心不全治療は新たな局面を迎えている(表1).種々のデバイスから適切なMCSを選択するためには,疾患の重症度と適切な病態の把握がより一層重要となっている2)3).本稿では,急性心不全治療におけるECMO管理の実際とその果たす役割について記す.

II.V-A ECMOの原理
ECMOは,経皮的に挿入される送血用カニューラと脱血用カニューラ,遠心ポンプ,体外膜型人工肺を用いた閉鎖回路で構成される.急性心不全に対して使用されるECMOの多くは,呼吸補助と循環補助の双方を目的とする静脈脱血・動脈送血のECMOシステム,すなわちperipheral V-A(Veno-arterial)ECMO(以下,V-A ECMO)である.一般に,脱血路として大腿静脈が,送血路として大腿動脈が選択される.呼吸補助のみを目的とする静脈脱血・静脈送血のV-V(Veno-Venous)ECMOは重症呼吸不全で使用され,詳細は他項に譲ることとする.
V-A ECMOでは,全身循環は自己心拍出量とECMO流量でまかなわれ,その補助形式は流量補助である.静脈系からの脱血は右心系の前負荷を減少させ,肺血流が減少し,その結果左室の前負荷が減少する.一方で,大腿動脈からの逆行性送血による大動脈圧の上昇は左室の後負荷は増加させる(表1).後述の如く,時には大動脈弁を閉鎖させ,肺うっ血の増悪や左心系血栓形成の可能性があることを知っておかなければならない.
わが国では,歴史的に経皮的心肺補助法(PCPS, Percutaneous cardiopulmonary support)と呼ばれていたが,国際的にはV-A ECMOと呼ばれることが一般的である.

III.V-A ECMOの適応
心肺停止蘇生例や難治性心室性不整脈,治療抵抗性の心原性ショックや低灌流性心不全が,V-A ECMOの適応である.重症心不全の重症度を示すINTERMACS/J-MACS分類のprofile 1または2が該当する(表2)2)4).V-A ECMOは,呼吸補助,左心補助,右心補助のすべてを行うことができ,これは左心補助のみを目的とするIABPやインペラとは,循環補助特性を異にする.すなわち,呼吸不全を合併した心不全(左心,右心,両心を問わない)や,両心不全,右心不全では,V-A ECMOが選択されなければならない.
V-A ECMO導入の目的は,心機能の回復を待つことはもちろんのこと,全身への組織灌流を維持して多臓器不全への進行を回避することである.すでに陥った多臓器不全からの回復を図るためには必要十分な全身組織灌流が必要である.肝不全を合併する場合には2.5L/min/m2,腎不全を合併する場合には2.8L/min/m2,感染を合併する場合には3.0L/min/m2の全身組織灌流が必要であると考える5).常に,V-A ECMOによる補助流量が必要十分かをアセスメントしながら治療を進めていくことが肝要である.
一方で,止血困難な出血性合併症や非可逆性脳障害,高度大動脈弁閉鎖不全症,高度な末梢血管疾患などはV-A ECMOの禁忌である.

IV.V-A ECMOの管理
最適なECMO管理を実現するためには,モニタリングが重要である.Swan-Ganzカテーテルによる血行動態パラメーター,動脈血ガス分析,肝・腎機能などの一般生化学検査,尿量などの一般臨床所見に加え,乳酸値は最も鋭敏に全身循環を表す指標の一つとして知られている.また,溶血の有無やECMOの回路内圧も重要な指標である.
ヘパリンによる抗凝固療法が必須である.活性化凝固時間(ACT, Activated clotting time)または活性化部分トロンボプラスチン時間(APTT, Activated partial thromboplastin time)で,ともに正常値の1.5~2倍程度を目標に調整される.時に,ヘパリン起因性血小板減少症(HIT, Heparin-induced thrombocytepenia)をきたすことがあり,血小板数の推移には注意する.HITではヘパリンを使用することができず,アルガトロバンが次の選択肢となる.
V.V-A ECMO管理中に発生する問題
溶血や下肢阻血はV-A ECMO管理の継続の可否に関わる合併症である.溶血は,不適切な回路内圧やカニューラサイズ不足,回路内血栓などにより生じ,持続する溶血は急性腎障害の原因となる.下肢阻血は,浅大腿動脈に細径シースを挿入することで下肢阻血を解除することができる(Distal perfusion).近年では多くの施設で,近赤外分光法(NIRS, Near-infrared spectoroscopy)による組織灌流モニタリング装置が使用されている.
左室後負荷の増大により大動脈弁が閉鎖したままとなると,左室拡張末期圧や左房圧の上昇,左心系での血液うっ滞による血栓形成をきたす可能性がある.血管拡張薬やIABPによる後負荷軽減,強心薬投与による左室収縮の強化を行うことで,大動脈弁の開放を期待するが,それでも大動脈弁が開放しない場合には,Impellaを併用したEcpella(V-A ECMO+Impella)6)7)や開胸操作による左室脱血を伴うセントラルECMO8)9)への治療のエスカレーションを検討する.
大腿動静脈経由のV-A ECMOでは,自己肺で酸素化された左室から駆出される順行性血流とECMOにより酸素化された大腿動脈からの逆行性血流が大動脈内で合流する.合流部位は,自己心拍出量とECMO流量とのバランスにより決定する(Mixing point8)).自己心からの拍出がほとんどなく(大動脈弁が閉鎖),全身循環がECMOに依存している血行動態であれば,冠動脈血流・脳血流はECMO由来の酸素化された血液でまかなわれる.しかし,自己心拍出があり,かつ高度に肺機能が障害された状態の場合には,冠動脈血流や脳血流が低酸素にさらされる可能性があることを知っておく必要がある.この現象を,differential hypoxia(North-South syndrome,Harlequin syndrome)8)という.Mixing pointを推定するために,可能な限り右上肢の動脈ラインで自己肺酸素化能をモニタリングする.同様の現象は,Ecpella下で増強される可能性があるために,Impellaの併用を行うにあたり注意を要する.
VI.複数カニュレーションによるECMO戦略10)
ECMO補助流量を増加させるため,もしくは大きく逸脱した回路内圧を是正するために,カニューラを追加することで治療をupgradeさせることができる.
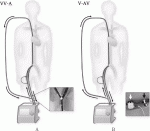
(1)VV-A(Venoveno-arterial)ECMO(図1A)
静脈脱血カニューラを追加することで,2本の脱血路によるECMOシステムを確立する.脱血不良による補助流量不足や過陰圧による溶血を解決することができる.
(2)V-AV(Veno-arteriovenous)ECMO(図1B)
送血カニューラを静脈系に追加することで,静脈脱血・動静脈送血のECMOシステムを確立する.V-A ECMOとV-V ECMOの両方の特徴を併せ持つ.動脈送血と静脈送血の血流バランスを設定することが重要である.
VII.開胸操作によるECMO(セントラルECMO)8)9)
末梢血管経由のV-A ECMOが何らかの理由により継続困難となった場合に,開胸操作によるセントラルECMOへのエスカレーションを検討する.進行する多臓器不全(ECMO流量不足),左心系血栓形成,改善しえない溶血や下肢阻血,ECMO治療の長期化などがその理由であることが多い.
一般に,右房脱血・上行大動脈送血によりV-A ECMOを確立し,必要に応じ左房または左室脱血を追加する.セントラルECMOの第1の利点は,高流量補助が可能となることである.大口径の脱血カニューラを右房に直接挿入することで脱血量を増加させ,心負荷を軽減させるとともに全身組織灌流を改善させることができる.さらに,リハビリテーションを含めた長期管理が可能である.自験例でも,セントラルECMOにエスカレーションすることで,補助流量の増加,回路内圧の改善,尿量の増加,LDH値の低下を認め,有意に血行動態が改善した.
一方で,導入・離脱に際して,繰り返し開胸操作が必要となるために,出血性合併症のリスクが増加するとともに,縦隔炎を含めた感染のリスクも増加する可能性がある.セントラルECMOによる血行動態の改善効果は大きいが,同時にリスク評価を適切に行い,その適応を慎重に見極める必要がある.
VIII.Bridge to BridgeとしてのECMO
適切なECMO管理にも関わらず,心機能が回復しない症例が存在する.その場合には,心臓移植を念頭に入れた補助人工心臓(VAD, Ventricular assist device)治療への移行(Bridge to Bridge)を検討する.VAD治療の詳細は他項に譲ることとするが,重症心不全におけるVAD治療のアルゴリズムに従い,治療を進めていく2).かつては,ECMOは心原性ショックからの回復を目指す急性期治療(Bridge to Recovery)に特化したデバイスであったが,現在は,心臓移植を含めた重症心不全治療の一翼を担うデバイスへと,その役割は拡大しており,その重要性はより一層高まっている.
IX.おわりに
急性心不全治療において,V-A ECMOはいまだ第一選択のデバイスとして治療の主役である.デバイスの特性と問題点を十分に理解し,最適の管理を行うことが治療成功のカギである.さらに,心臓移植を含めた重症心不全治療の一翼を担うデバイスへと,その役割は拡大しており,ECMO治療の重要性はより一層高まっている.
利益相反:なし
文献
1) 日本循環器学会:循環器疾患診療実態調査報告書(2019年実施・公表)[ http://www.j-circ.or.jp/jittai_chosa/jittai_chosa2018web.pdf]
2) 日本循環器学会/日本心不全学会合同ガイドライン.急性・慢性心不全診療ガイドライン(2017年改訂版)[https://www.j-circ.or.jp/cms/wp-content/uploads/2017/06/JCS2017_tsutsui_%E3%82%AA%E3%83%AA%E3%82%B7%E3%82%99% E3%83%8A%E3%83%AB%E7%89%88_190830.pdf]
3) Atkinson TM, Ohman EM, O’Neill WW, et al.: A Practical Approach to Mechanical Circulatory Support in Patients Undergoing Percutaneous Coronary Intervention. An Interventional Perspective. J Am Coll Cardiol Intv, 9: 871-883, 2016.
4) Stevenson LW, Pagani FD, Young JB, et al.: INTERMACS profiles of advanced heart failure:the current picture. J Heart Lung Transplant, 28: 535-541, 2009.
5) Nishimura M, Nishimura T, Ishikawa M, et al.: Importance of luxury flow for critically ill patients receiving a left ventricular assist system. J Artif Organs, 9: 209-213, 2006.
6) Pappalardo F, Schulte C, Pieri M, et al.: Concomitant implantation of Impella on top of veno-arterial extracorporeal membrane oxygenation may improve survival of patients with cardiogenic shock. Eur J Heart Fail, 19: 404-412, 2017.
7) Patel SM, Lipinski J, Al-Kindi SG, et al.: Simultaneous venoarterial extracorporeal membrane oxygenation and percutaneous left ventricular decompression therapy with Impella is associated with improved outcomes in refractory cardiogenic shock. ASAIO, 65: 21-28, 2019.
8) Rao P, Khalpey Z, Smith R, et al.: Venoarterial extracorporeal membrane oxygenation for cardiogenic shock and cardiac arrest. Circ Heart Fail, 11:e004905, 2018.
9) Raffa GM, Kowalewski M, Brodie D, et al.: Meta-analysis of peripheral or central extracorporeal membrane oxygenation in postcardiotomy and non-postcardiotomy shock. Ann Thorac Surg, 107: 311-321, 2019.
10) Napp LC, Kühn C, Hoeper MM, et al.: Cannulation strategies for percutaneous extracorporeal membrane oxygenation in adults. Clin Res Cardiol, 105: 283-296, 2016.
PDFを閲覧するためには Adobe Reader が必要です。