日外会誌. 121(6): 579-585, 2020
特集
ECMO,補助循環装置の進歩
3.小児外科におけるECMO
|
大阪母子医療センター 小児外科 臼井 規朗 |
ECMOは,小児外科領域においても新生児や乳児期以降の小児の呼吸不全に対する最も強力な呼吸補助手段である.Extracorporeal Life Support Organization(ELSO)に登録された小児のECMO症例のうち,約30%は新生児の呼吸補助目的に施行され,約20%は非新生児の呼吸補助目的に施行されている.ELSOでは,呼吸補助を目的とした新生児ECMO後の生存率は64〜73%,非新生児ECMO後の生存率は59%と報告している.
かつてECMOが主な治療手段であった重症の先天性横隔膜ヘルニア(以下,CDH)は,新生児遷延性肺高血圧が内科的な管理で治療できるようになったことで近年生命予後が著しく改善した.そのため,わが国ではCDHに対するECMOの使用例は著明に減少しており,ECMOの使用頻度は7%と条件の限られた症例に対してのみ行われている.またわが国では,ECMOは気道の先天性異常に対する再建手術時の有用な呼吸管理手段と位置づけられている.
近年では胎児に対するECMOを用いた人工胎盤・人工子宮の研究が著しい成果を上げている.Partridgeらは新しい人工子宮システムを開発し,ヒトの在胎23週〜27週に相当する羊胎仔を,人工羊水を満たしたプラスチックバッグの中で4週間保育することに成功し,人工子宮の中でも呼吸機能や中枢神経機能が正常に発達することを証明した.
キーワード
ECMO, 新生児, 先天性横隔膜ヘルニア, 人工胎盤, 人工子宮
I.はじめに
小児外科領域におけるECMOと言えば,新生児に発症する先天性横隔膜ヘルニア(以下,CDH)に対して用いられるイメージが強い.実際に,北米を中心として,CDHに伴う新生児遷延性肺高血圧(以下,PPHN)に対しては依然ECMOが高頻度に使用されている.一方,呼吸管理や循環管理の進歩によってPPHNが概ね克服されて予後が著しく改善したため,わが国ではCDHに対するECMOの使用頻度は著明に減少した1)2).しかし,小児外科領域でもECMOが新生児や乳児期以降の小児の呼吸不全に対する最も強力な呼吸補助手段であることには今も変わりはない.加えて,近年では胎児に対して行うECMOを利用した人工胎盤・人工子宮の研究が著しい成果を上げている3).そこで本項では,欧米やわが国において新生児を含む小児の呼吸不全に対して用いられているECMOの現状について記述したあと,目覚ましい進歩を遂げて脚光を浴びている人工胎盤・人工子宮の研究についても解説する.
II.小児におけるECMO
Extracorporeal Life Support Organization(ELSO)に登録されたデータによると,17歳未満の小児に対するECMOは過去10年間で25,000例以上が施行されており,年間あたりの施行症例は現在も増加傾向にある4).2015年単年では,227の施設から2,992例がELSOに登録されているが,このうちの約84%は北米または欧州の症例である5).小児にECMOが施行される理由は,呼吸補助目的,循環補助目的,体外循環式心肺蘇生目的に大別されるが,施行年齢によって日齢28日までに行われる新生児ECMOと,乳児期以降17歳までに行われる非新生児ECMOとに分けられる.小児のECMO症例全体の中での割合は,呼吸補助を目的として行われる新生児ECMOが約30%,呼吸補助を目的として行われる非新生児ECMOが約20%であり5),小児のECMO症例の約半数は呼吸補助を目的として行われている.これら呼吸補助目的のECMOの駆動方法は,非新生児ECMOの55%が遠心ポンプで行われているのに対し,新生児ECMOではローラーポンプの方が54%と多い5).また,非新生児ECMOでは静脈脱血静脈送血(VV-ECMO)が61%であるのに対し,新生児ECMOでは静脈脱血動脈送血(VA-ECMO)が69%を占めている5).ECMOの継続期間は,CDH以外の新生児ECMOでは通常2週間以内である.しかし,非新生児ECMOでは非常に長い期間継続される場合もあり,もっとも長期間施行された症例は,気道熱傷後に急速に進行する多臓器不全を発症した7歳の患児で,合計20カ月間ECMOを継続したのち,離脱に成功したと報告されている6).
III.呼吸補助目的の新生児ECMO
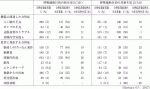
呼吸補助を目的として行われる新生児ECMOは,減少傾向にあるものの小児のECMO症例の中では最も多く,生存率も64〜73%と比較的高い4)5).適応となる疾患は,CDHの32%が最も多く,次いで胎便吸引症候群24%,原発性PPHN21%,敗血症4%,その他18%である(表1)5).CDHも胎便吸引症候群も適応となる病態はPPHNであるため,新生児ECMOの約8割はPPHNの治療のために行われているといえる.ECMO後の生存退院率は,胎便吸引症候群が93%と高率であるのに対しCDHは50%しかない5).これは,CDHの呼吸不全は,背景にPPHNのみならず肺低形成があるためと考えられる.
新生児ECMOの適応は,適切な内科的治療や呼吸管理を行っても治療できない可逆的な呼吸不全を呈する場合である.導入の客観的基準の一つとしてOxygenation Index(OI;OI=平均気道内圧×FiO2×100/PaO2)が用いられている.ELSOのガイドラインではOI≧40が4時間以上続く場合と記されている.その他の適応として,48時間以上最大限の治療を行ってもOI≧20を示す,あるいは酸素投与が100%から減量できない場合,介入にも関わらず急激にPaO2が40mmHgを下回る高度な低酸素性呼吸不全を来す場合,右心不全または左心不全を伴う高度の肺高血圧症,強心剤に抵抗性の低血圧などが挙げられている4)5).また,CDHでは,気圧外傷を避けるためにもっと低いOIでもECMOの適応とすべきという考え方もある4).
新生児ECMOの適応禁忌としては,13トリソミーや18トリソミーなどの重篤な染色体異常,不可逆的な脳障害,大量あるいはコントロールできない出血,Ⅲ度以上の頭蓋内出血などが挙げられている.また,相対的適応禁忌として,在胎週数34週未満,体重2kg未満,人工呼吸期間が2週間を越える場合などが挙げられている4).新生児ECMOの合併症は,機器に関連したものでは送脱血管のトラブルが12%と最も多く,患者に発症するものでは頭蓋内出血が11%と最も多い(表2)5).

IV.呼吸補助目的の非新生児ECMO
呼吸補助を目的として行われる非新生児ECMOの生存率は59%と報告されている5).多くの症例の施行理由がPPHNであった新生児ECMOとは異なり,非新生児ECMOが適応となるのは肺実質の疾患が原因の呼吸不全が多い.急性呼吸不全が22%と最も多く,次いでその他21%,気管支炎10%,ウイルス性肺炎10%,細菌性肺炎10%,肺以外の感染症8%である4).
非新生児ECMOの適応は,PaO2が60mmHg以下やOIが40以上など高度の呼吸不全を呈する場合である.ELSOのガイドラインでは,その他の適応として高頻度振動換気や一酸化窒素吸入療法などと組み合わせた従来型換気法で反応がみられない場合や,従来型換気法で20~25mmHg以上,高頻度振動換気法で30mmHg以上の平均気道内圧を要する場合が挙げられている4).
非新生児ECMOの適応禁忌としては,重篤な染色体異常,脳神経外科術後や頭蓋内出血後10日以内,高度の頭部外傷,出血のリスクの高い術後や外傷後,根治性のない悪性腫瘍などが挙げられている.非新生児ECMOの合併症は,機器に関連したものでは送脱血管のトラブルが15%と最も多く,患者に発症するものでは術創からの出血が10%と最も多い(表2)5).

V.わが国の小児外科領域におけるECMO
わが国における呼吸補助目的の新生児ECMOについて,Hirakawaら7)は過去21年間に自施設で経験した61例について報告している.適応となった疾患はCDH16例,胎便吸引症候群14例,PPHN8例,敗血症7例,その他16例であり,胎便吸引症候群の生存率が86%と良好であったのに対し,CDHの生存率は31%と不良であった7).
小児外科領域でしばしば問題となる新生児のCDHに対するECMOは,近年,欧米とわが国の間で適応や位置づけに違いが出てきている.欧米では施設による差はあるものの,新生児のCDHの30%程度の症例に対してECMOが用いられている8).わが国でも1990年代には新生児のCDHのうち29~49%の症例に対してECMOが用いられていた9)10).ところがgentle ventilationを中心とした呼吸管理や一酸化窒素吸入療法の普及,動脈管の開存維持による右心不全の回避などの内科的管理によってPPHNが概ねコントロールできるようになると,わが国におけるCDHに対するECMOの施行数は著明に減少した.2011年に行われたわが国の全国調査では,ECMOが用いられたCDHは614例中43例(7%)しかなく,欧米に比べて明らかに少数であった1).これら43例中,重篤な合併異常を伴わなかったCDH単独例は37例で,このうち21例がECMOを離脱した.しかし,生存退院できたのは15例で,在宅医療を必要としない状態で退院できたのは8例のみであった2).Inamuraらはこの理由として,わが国では内科的治療で管理できない非常に重症な症例に対してだけECMOが用いられているためと推測している2).新生児CDH診療ガイドライン11)ではクリニカルクエスチョン「新生児CDHの予後改善のためにECMOは有効か?」に対してシステマティックレビューが行われたが,新生児CDHにおいてはECMOが一律に有効であるとは言い切れず,矢本らはCDHに発症する気胸などの可逆性の呼吸障害に対してECMOがもっとも効果を発揮すると述べている12).
呼吸補助目的の非新生児ECMOについては,わが国では肺炎の治療だけでなく,気道の先天性異常に対する再建手術の際の有用な呼吸管理手段としても位置づけられている13)14).
VI.人工胎盤・人工子宮の開発
小児外科領域では,古くから人工胎盤あるいは人工子宮に興味が持たれてきた.海野は,人工胎盤・人工子宮の概念を「出生後の環境および呼吸循環動態では生存不可能な胎児を対象とし,体外循環による呼吸のtotal supportを長期間にわたって行い,胎外生存可能な状態になるまで,子宮内に近い条件で成長・成熟させるシステム」と説明している15).子宮内で胎児を成長発育させる胎盤は,胎児血液の酸素化と脱二酸化炭素化以外にも,胎児への栄養供給,胎児からの老廃物の除去,胎児の水・電解質の調整,胎児へのホルモンの供給などを行っている.すなわち胎盤は,胎児の未熟な肺や腸管,肝臓,腎臓などの臓器の機能を代行する人工臓器の集合体と見なすこともできる.人工胎盤・人工子宮は,これら胎盤の機能をさまざまな人工臓器の組み合わせによって代行させようという試みであるが,この中では人工肺,すなわちECMOがその中心となっている.
人工胎盤の研究が最初に行われたのは,60年以上過去に遡る.その後わが国では,東京大学産婦人科のグループによって盛んに実験が行われ,1993年にはヤギ胎仔に臍帯動静脈を通じた送脱血でAV-ECMOを行い,人工羊水を満たした水槽の中で3週間保育することに成功した16).しかし,当初人工胎盤は肺の未熟性の著しい超早産児の呼吸管理が開発の目的であったため,人工呼吸管理を中心とした出生後の超早産児に対する新生児医療のレベルが向上するとともに,その臨床的意義は次第に薄れていった.ところが今世紀に入り,胎児鏡下手術などの胎児治療が盛んに行われるようになると,胎児治療後の早産児の治療のために人工胎盤・人工子宮の必要性が高まり,再び研究が盛んに行われるようになった.
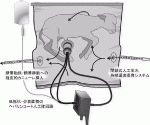
2017年,フィラデルフィア小児病院の小児外科医Partridgeらは,子宮外新生児発育環境(Extrauterine environment for neonatal development;EXTEND)と名付けた人工子宮システムを開発し,ヒトの在胎23週〜27週に相当する在胎105〜117日,体重1.3〜2.4kgの羊胎仔を20〜28日間保育することに成功した(図1)3)17).この人工子宮システムでは,体外循環は臍帯動脈に挿入したカテーテルから脱血し,臍帯静脈に挿入したカテーテルから送血してポンプレスで行う.人工肺の抵抗が極めて低いため,胎児自身の心拍出のみで体外循環は維持されるという.呼吸を開始する前の胎仔を人工羊水で満たしたBiobagと名付けた無菌のプラスチックバッグに入れて,温度と圧をコントロールしながら閉鎖式に人工羊水を循環させる.回路と人工肺はヘパリンコーティングされているため抗凝固剤は要さない.
この人工子宮システムの下で羊胎仔の血液ガスや心拍数,血圧などは4週間非常に安定しており,栄養として炭水化物やアミノ酸,少量の脂質を投与し,エリスロポイエチンとインスリンを追加するだけで,胎仔は正常に身体発育することが示された.心機能,肺の発達,呼吸機能,生化学データ,脳の発達,脳の血流,髄鞘形成,脳内の出血の有無などを評価しているが,いずれも正常の胎仔と同様の発達を示すことが証明されている3).彼らはさらに,ヒトであれば体重500~850gの胎児と同じ太さの臍帯を有する在胎85~96日の羊胎仔に対しても同様の実験を行い,臍帯動静脈からの送脱血によって人工子宮システムが利用できることを確認している18).
VII.おわりに
小児外科領域においては,かつて新生児のCDHにECMOが盛んに用いられていたが,最近はその機会が減少した.しかし,決して小児外科におけるECMOの重要性が少なくなったわけではない.今後は新生児から超未熟児や胎児へとECMOの活躍の場が広がっていくことが期待されている.
利益相反:なし
文献
1) Nagata K, Usui N, Kanamori Y, et al.: The current profile and outcome of congenital diaphragmatic hernia:A nationwide survey in Japan. J Pediatr Surg, 48: 738-744, 2013.
2) Inamura N, Usui N, Okuyama H, et al.: Extracorporeal membrane oxygenation for congenital diaphragmatic hernia in Japan. Pediatr Int, 57: 682–686, 2015.
3) Partridge EA, Davey MG, Hornick MA, et al.: An extra-uterine system to physiologically support the extreme premature lamb. Nat Commun, 8: 15112, 2017.
4) Etchilla EW, Dante SA, Garcia AV: Extracorporeal membrane oxygenation in thepediatric population - who should go on, and who should not. Curr Opin Pediatr, 32: 416-423, 2020.
5) Barbaro RP, Paden ML, Guner YS, et al.: Pediatric extracorporeal life support organization registry international report 2016. ASAIO J, 63: 456-463, 2017.
6) Nelson-McMillan K, Vricella LA, Stewart FD, et al.: Recovery from total acute lung failure after 20 months of extracorporeal life support. ASAIO J, 66:e11-e14, 2020.
7) Hirakawa E, Ibara S, Tokuhisa T, et al.: Extracorporeal membrane oxygenateon in 61 neonates: Single-center experience. Pediatr Int, 59: 438-442, 2017.
8) Lally KP: Congenital diaphragm hernia - the past 25 (or so) years. J Pediatr Surg, 51: 695-698, 2016.
9) Kamata S, Usui N, Ishikawa S, et al.: Prolonged preoperative stabilization using high-frequency oscillatory ventilation dose not improve the outcome in neonates with congenital diaphragm hernia. Pediart Surg Int, 13: 542-546, 1998.
10) Nagaya M, Kato J, Miimi N, et al.: Analysis of patients with congenital diaphragm hernia requiring pre-operative extracorporeal membrane oxygenation (ECMO). Pediart Surg Int, 14: 25-29, 1998.
11) 新生児先天性横隔膜ヘルニア研究グループ:新生児CDHの予後改善のためにECMOは有効か? 新生児先天性横隔膜ヘルニア(CDH)診療ガイドライン.メジカルビュー社,東京,pp63-68, 2016.
12) 矢本 真也,照井 慶太,永田 公二,他:ECMOの役割.小児外科,48: 470-474, 2016.
13) Hasegawa T, Oshima Y, Matsuhisa H, et al.: Clinical equivalency of cardiopulmonary bypass and extracorporeal membrane oxygenation support for pediatric tracheal reconstruction. Pediatr Surg Int, 32: 1029-1036, 2016.
14) Kawahara I, Maeda K, Samejima Y, et al.: Repair of type IV laryngotracheoesophageal cleft (LTEC) on ECMO. Pediatr Surg Int, 35: 565-568, 2019.
15) 海野 信也:人工子宮―人工胎盤revisited.医のあゆみ,261(13): 1235-1239, 2017.
16) Unno N, Kuwabara Y, Okai T, et al.: Development of an artificial placenta:Survival of isolated goat fetuses for three weeks with umbilical arteriovenous extracorporeal membrane oxygenation. Artificial Organs, 17: 996-1003, 1993.
17) Partridge EA, Davey MG, Hornick MA, et al.: An Extrauterine environment for neonatal development:Extending fetal physiology beyond the womb. Semin Fetal Neonatal Med, 22: 404-409, 2017.
18) Hornick MA, Mejaddam AY, McGovern PE, et al.: Technical feasibility of umbilical cannulation in midgestation lambs supported by the Extra-uterine Environment for Neonatal Development (EXTEND). Artificial Organs, 43: 1154-1161, 2019.
PDFを閲覧するためには Adobe Reader が必要です。