日外会誌. 121(5): 535-539, 2020
会員のための企画
がんの近赤外光線免疫療法の開発経緯と今後の展望―外科治療との関わりも含めて―
|
米国国立がん研究所(NCI),米国国立衛生研究所(NIH) 小林 久隆 |
臨床におけるがんの3大治療方法は,半世紀以上にわたって変わらず外科手術,放射線治療,化学療法(抗がん剤)である.どの治療法も体の中のがん細胞を減らすことには合理性があるが,がん細胞だけを取り除くまたは攻撃して殺してしまう事は今のところできていない.そのため,治療後の後遺症や副作用とともに免疫低下の原因となり患者を苦しめている.私たちの開発した超細胞選択的がん治療である近赤外光線免疫療法(一般には光免疫療法:Near Infrared Photoimmunotherapy;NIR-PIT)は,これまでのがん治療とは異なるアプローチのがん治療である.この稿では,まず近赤外光線免疫療法の治療理論について既存のがん治療との違い,特に光治療+免疫療法であることの所以について論じたい.次に,「近赤外光線免疫療法」の化学・物理学・生物学を統合した理論に基づいた開発理念について論じ,さらに従来のがん治療法と比較した優位点について論じる.また,5年前から行われてきた近赤外光線免疫療法の再発頭頸部がんに対する臨床治験についても少し触れる.加えて,近赤外光線免疫療法の治療対象となるがんの種類,標的分子,病態,さらに,近赤外光線免疫療法を免疫抑制細胞に対して用いることで可能になるがんに対する強力な免疫誘導,免疫賦活とがんに対する近赤外光線免疫療法の併用の協調効果など多様な応用法について論じたい.また,既存の外科治療とどのように組み合わせていくかに関しても考察する.
キーワード
近赤外光線免疫療法, がん, 腫瘍免疫, 外科手術, 併用療法
I.はじめに
半世紀以上前から現在に至るまで,臨床におけるがんの3大治療方法は,変わらず外科手術,放射線治療,化学療法(抗がん剤)である.がんは言うまでもなく体の中にがん細胞と言う余分な細胞が増殖することによって起こる病気であるので,これらの細胞を取り去るあるいは体の中にあるこれらの細胞を減らしていくことががん治療の目的となる.その意味では3大治療はすべて直接がん細胞を攻撃しまたは取り去って体の中にあるがん細胞を無くす,または,減らしていくことを目的にしているので合理的な方法である.ただどの治療法も体の中のがん細胞だけを取り除く,または,攻撃して殺してしまう事は今のところできていない.正常な細胞も取り去られたりダメージを受けたりするのでそれががんの治療の副作用の原因となり患者を苦しめている.
また近年がんに対する宿主の免疫の機構が科学的に解明されることにより,患者体内の免疫力を増強することによってがんを治す様々ながん免疫療法が確立してきた.ところが前記の3大治療はいずれも,直接攻撃してがん細胞の生体内の数を減らすことはできるが,正常細胞,特にその中でも免疫担当細胞を強く傷害することによって,生体のがんに対する免疫を落としてしまう.例えば,外科治療は定型的には腫瘍と共に所属リンパ節を切除する.これは,がんと戦っている腫瘍内浸潤リンパ球に加えて,がんに対する免疫の役割も担うリンパ組織も失われてしまう.放射線治療は通常,がんに対しては60~80Gy(2Gy/日×30~40回)の放射線の照射を必要とするが,がんと闘うのに最も重要なTリンパ球は放射線感受性が高く2~3Gyの照射で死んでしまう.従って,最初の2日間の照射で腫瘍内および周辺のリンパ球はすべて死に絶えてしまい,治療終了後にリンパ球が回復するまでは腫瘍免疫はほぼ期待できないことになる.一般の化学療法剤も同様で,多くの場合分裂が盛んな細胞が障害されることが多いため,血球系の細胞は障害されることが多く,白血球やリンパ球の減少は頻繁に認められる副作用である.
一方,現在のがん免疫療法は,免疫賦活効果を持つ薬剤を用いるサイトカイン療法や免疫チェックポイント阻害剤,がんの特異抗原を同定して狙うワクチン療法やCAR-T療法などすべて,がん患者の中にある既存の免疫細胞を活性化するか,一つのがんに特異的と思われる抗原を狙った免疫細胞を加えることによって,その免疫細胞ががん細胞を死滅させることで,がんを治癒させるわけである.従って,これらの免疫療法自体によっては一つもがん細胞が死滅させられることはないわけで,がんを完治させるためには活性化された免疫細胞が生体内にあるすべてのがん細胞と戦い死滅させる必要がある.がん細胞を死滅させるためには,非常に多くの免疫細胞が必要になり,元来患者の体の中にある,あるいは培養して投与された免疫細胞の数と質が十分でなければ,免疫療法は十分な効果が得られない.
II.近赤外光線免疫療法の開発理念
従って理想的ながん治療とは,生体内にあるがん細胞の数を減らしながら,がんに対する免疫を増強あるいは少なくとも現状維持できる治療である.しかし現状では,そのような治療は既存の治療の組み合わせでは実現することができない.このような治療を合理的に実現するためには,まず免疫細胞を含めた正常細胞を傷つけることなく可能な限りがん細胞のみを死滅させ,そしてさらに,死滅したがん細胞を物理的に壊すことによって,がん細胞に存在する抗原を認識部位が障害されない形で免疫細胞に認識させてより良い免疫を誘導する必要がある.
私たちは長年にわたってより良い画像診断法を開発する方法論として「正常細胞を光らせず,がん細胞のみを光らせて見せる」ことによって画像上で高いコントラストを実現することを研究テーマとして追究してきた.この高い選択性を持つ診断技術の開発に用いたものと同様の集学的な物理・化学・生物の統合に基づく合理的な開発理論と手法を用いることによって,治療効果においても細胞レベルでの高い特異性を持たせることができた.その結果として,正常細胞とがん細胞との殺傷効果に高いコントラストを得ることによって,選択的にがん細胞を破壊し,正常細胞に対しては高い安全域を持つ治療法を開発することができた.また,医学上の利点に関しては,このような理論に基づいて,「正常細胞を傷つけることなく,特異的に体内のがん細胞を破壊する」ことができれば,患者の体に大きな負担を与えることなくがん細胞を減らし,また,治療によって障害されない免疫機構によって壊したがん細胞に対する腫瘍免疫を十分に高めていくことにより,遠隔転移に対してもより効果があり,かつ一旦,完治すれば再発しないような治療が行えるはずである.そして私たちはこの具体的な方法として2011年にこの近赤外光線免疫療法(一般的には光免疫療法:Near Infrared Photoimmunotherapy;NIR-PIT)を完成した.
III.近赤外光線免疫療法の原理
数ある既存の生体内分子の中で,生きた細胞の膜表面分子に最も特異的に安定して結合する事ができる種類の分子は,抗体をおいてほかにない.実際に現在でも,病理でのがん診断の多くは抗体の特異性を用いた免疫組織化学染色によるところがほとんどである.
さらに物理,化学的な効果で,がん細胞に選択的にダメージを与えるためには,標的細胞においてのみ局所で物理的,あるいは化学反応を起こすエネルギーを効率よく発生する必要がある.既知の現象の中では,光化学反応がこのような効果を起こしうるものである.ところが,生物で光を使うためには,いくつかの限界がある.光化学反応を効率よく起こすためには,エネルギーの高い光子(波長の短い電磁波)を用いる必要がある.しかし,X線やγ線を含む,紫外線よりも短い波長の光を浴びると,すべての細胞はDNAに損傷を起こしてダメージを受けてしまう.従って,がん細胞のところでのみ細胞毒性を起こすには,可視光かそれより長い波長の光を使う必要がある.さらに,生体内にはコラーゲン,ヘモグロビン,水,といった光の吸収物質が多々あるため,体の深部まで治療するために十分な光子を到達させるためには,波長が700ナノメートルから850ナノメートル程度の近赤外I領域の光子を使用する必要がある1).
次に私たちは,抗体に結合させる事によってがん細胞上に運ぶ事ができる分子で,そこで効率よく700ナノメートルから850ナノメートルあたりの近赤外領域の光子を吸収して,抗体の付着した細胞のみを殺傷する事ができる化学物質の選択を試み,その中から,最も効率よく細胞障害を起こせる抗体結合化合物を選んだ.それが,IRDye700DX(IR700)といわれるSilicon-Phthalocyanineの誘導体である.予想通り,抗体-IR700結合体は細胞の実験でも生体内の腫瘍の実験でも,特異的かつ効率的な細胞障害効果を出す事ができた.このような理論的な背景と至適物質の選択に基づいて,近赤外線を用いた近赤外光線免疫療法は開発された(図1).
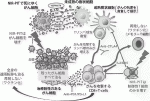
IV.近赤外光線免疫療法の機序と効果
近赤外光線免疫療法の効果は,既存の他のがん治療と比べるとかなり異なるものである.近赤外光を照射している間に,IR700に起こる光化学反応によって抗体-IR700結合体の付着している膜抗原タンパクを介して非常に急速な脂質二重膜の機能障害が進んで2),細胞形態が変化し主として細胞質の内容物が漏出して数分以内に壊死性細胞死(別名:免疫原性細胞死)がおこる3).従って,抗体-IR700結合体の結合した細胞のみを殺傷することができるわけである.実際に,抗原を発現させた細胞と抗原を発現させない細胞との共培養系を用いて,抗原を発現している細胞が完全に死滅させる条件で近赤外光線免疫療法を行っても,隣接する抗原を発現していない細胞は全く障害を受けない1).
V.近赤外光線免疫療法による腫瘍免疫増強のメカニズム
近赤外光線免疫療法は,がん細胞を壊して減らすことに加えて,がん細胞に対する免疫を合理的に活性化させることができる.そこには次のような理由がある.前述したように,近赤外光線免疫療法は狙った細胞の細胞膜の機能を障害して細胞を破裂させることにより,選択的に壊死性(免疫原性)細胞死を引き起こす.この細胞死が「免疫原性」と言われる所以は,このような形で選択的にがん細胞のみを壊した場合には,がん細胞構成物(タンパク,核酸など)が,障害されない形で放出されて近傍の樹状細胞を活性化するとともに,良質の腫瘍抗原としてリンパ球に提示される.さらに近赤外光線免疫療法では,がん細胞から放出されるATP,Calreticulin,HMGB1といった細胞死のシグナルが樹状細胞の成熟を促進するため,放出される新鮮で条件の良い抗原分子を用いて攻撃型リンパ球の教育を行うことができる.そのため,新たに教育された多クローンのがん特異抗原を認識できるリンパ球を誘導することができる.結果的に,近赤外光線免疫療法単独でも,がん細胞を減らすのみならず,腫瘍免疫も増強することができるわけである.
近赤外光線免疫療法の手法を利用して,さらに強力に腫瘍免疫を増強することができる.それは,同様の方法を用いて免疫抑制細胞を標的にした近赤外光線免疫療法で,短時間に免疫抑制細胞をほとんど取り除いてしまうことにより,がん免疫を活性化する免疫増強療法にも応用できる4).制御性T細胞(Treg)や骨髄由来抑制細胞(MDSC)は,樹状細胞から細胞傷害性リンパ球まで多くの機序での免疫抑制を行っているので,全身で取り除くと自己免疫疾患を含む様々な副作用を起こしてしまう危険がある.一方,近赤外光線免疫療法は腫瘍内と周辺に存在している局所の免疫抑制細胞を取り除くことで,腫瘍特異的な免疫を局所のみならず全身で誘導し,局所の残存細胞に加えて遠隔転移腫瘍に対しても大きな副作用なく抗腫瘍効果を出すことができる.この当初から命名にあった近赤外光線免疫療法の「免疫療法」の部分に関しても,米国国立衛生研究所(NIH)内での臨床治験の準備を進め,現実のものとなりつつある.
このがん細胞を標的として壊して減らすとともに,リンパ球を教育することを目的とした近赤外光線免疫療法と,免疫抑制細胞を標的にして腫瘍免疫を増強することを目的とした近赤外光線免疫療法は,相乗効果をあげることができる5).従って,がん細胞標的と免疫抑制細胞標的の二つの抗体IR700結合体を同時に投与してから,全く同様の手技で近赤外光を照射することによって,より強力な近赤外光線免疫療法を行うことが可能になった.更に他の免疫増強法とも併用しながら最適な方法を決定するための前臨床試験を進めている(図1)6).

VI.近赤外光線免疫療法の適応と臨床治験
近赤外光線免疫療法は,全く新しい概念のがん治療であると同時に,方法論としては,「周囲の細胞を傷害することなく,ある種の細胞を生体の局所から取り除くことができる」初めての方法である.もちろん,細胞膜の分子標的が可能な通常のがんは,すべてその適応となる事であろう.中でも,現実的には米国食品医薬品局(FDA)に既に認可され臨床でがんの治療に用いられている抗体の効果を近赤外光線免疫療法で飛躍的に増強するのが,臨床応用への最も早道である.実際,近赤外光線免疫療法開発より3年半後の2015年5月よりFDAによって既に薬剤承認されている抗体Cetuximab-IR700結合体を用いて,Epidermal growth factor receptor(EGFR)を標的にした頭頸部および上部食道の扁平上皮がんに対する第1相臨床治験を,米国国立がん研究所(NCI)が近赤外光線免疫療法のパテントをライセンスしているAspyrian Therapeutics(現Rakuten Medical)社が開始した(https://clinicaltrials.gov/ct2/show/NCT02422979).2017年には第2相が終了し,2018年および2019年の米国臨床腫瘍学会にて良好な結果が報告されたことにより,早期承認制度に基づいた世界での第3相へと進むことがRakuten Medical社より周知されている.
VII.外科治療と近赤外光線免疫療法併用
近赤外光線免疫療法と外科治療の併用に関しては,現在行われている術前の化学療法や放射線治療の代わりに近赤外光線免疫療法で腫瘍を縮小させ,免疫反応を十分に励起した後にダウンステージした腫瘍に対して縮小手術を行う.あるいはうまく腫瘍が消失した場合には手術を回避することも可能であると考えている.ステージの進んだより進展した腫瘍の場合には,腫瘍内の近赤外光の透過距離には限界があるため,術前に抗体IR700結合体を投与しておいて,まず蛍光ガイドの手術によって大きな切除しやすい部分を取り去って腫瘍を減量し,神経や血管への浸潤などで切除しにくい部分に関しては近赤外光線免疫療法を行って残存するがん細胞を死滅させるとともに,がん細胞に対する免疫を励起することを目指すことが合理的なのではないかと考えている.そのため,近赤外光線免疫療法が外科手術の創傷治癒に影響しないかという検討も行っているが,現在のところ特に問題は見つかっていない.
VIII.おわりに
細胞膜上分子を標的にした超選択的がん治療「近赤外光線免疫療法」の開発理論とその抗腫瘍および免疫賦活効果,さらに前臨床試験での応用,臨床応用の現状について解説した.理論的には,このような超特異的がん治療は,がんに対しては強力でありながら,正常組織のダメージは少なく,かつ,腫瘍特異的な免疫誘導が可能な,患者にとって有効かつやさしい,怖がることなく受けることができるがん治療となりうるはずである.
利益相反:なし
文献
1) Mitsunaga M, Ogawa M, Kosaka N, et al.: Cancer cell-selective in vivo near infrared photoimmunotherapy targeting specific membrane molecules. Nat Med, 17: 1685-1691, 2011.
2) Sato K, Ando K, Okuyama S, et al.: Photoinduced Ligand Release from a Silicon Phthalocyanine Dye Conjugated with Monoclonal Antibodies: A Mechanism of Cancer Cell Cytotoxicity after Near-Infrared Photoimmunotherapy. ACS Cent Sci, 4: 1559-1569, 2018.
3) Ogawa M, Tomita Y, Nakamura Y, et al.: Immunogenic cancer cell death selectively induced by near infrared photoimmunotherapy initiates host tumor immunity. Oncotarget, 8: 10425-10436, 2017.
4) Sato K, Sato N, Xu B, et al.: Spatially selective depletion of tumor-associated regulatory T cells with near-infrared photoimmunotherapy. Sci Transl Med, 8: 352ra110, 2016.
5) Maruoka Y, Furusawa A, Okada R, et al.: Combined CD44- and CD25-targeted near-infrared photoimmunotherapy to selectively kill cancer and regulatory T cells in syngeneic mouse cancer models. Cancer Immunol Res, 2020. in press.
6) Nagaya T, Friedman J, Maruoka Y, et al.: Host Immunity Following Near-Infrared Photoimmunotherapy Is Enhanced with PD-1 Checkpoint Blockade to Eradicate Established Antigenic Tumors. Cancer Immunol Res, 7: 401-413, 2019.
PDFを閲覧するためには Adobe Reader が必要です。