日外会誌. 121(4): 423-428, 2020
特集
食道癌診療の現況と展望
4.内視鏡治療
|
東京医科歯科大学 消化管外科 川田 研郎 , 中島 康晃 , 東海林 裕 , 星野 明弘 , 松井 俊大 , 山口 和哉 , 松山 貴俊 , 徳永 正則 , 絹笠 祐介 |
食道癌の内視鏡診断や治療後の経過観察に上部消化管内視鏡は大きな役割をはたしている.過去にはヨード染色による早期食道癌スクリーニングが主流であったが現在はNBIを始めとした画像強調内視鏡で早期癌の拾い上げが容易となった.1980年代には粘膜癌でも食道切除再建術や放射線治療が行われていたが,1990年代から内視鏡的粘膜切除術(Endoscopic Mucosal Resection,EMR),さらに2000年代に入り内視鏡的粘膜下層剥離術(Endoscopic Submucosal Dissection,ESD)が開発され,食道早期癌に適応されるようになった.任意の大きさに一括切除可能なESDは多分割EMRの問題であった局所再発率を下げ,また各種デバイスや高周波凝固装置の改良により,穿孔や出血を回避でき,安全で低侵襲な治療を提供できることになった.さらに周在性の広い病変に対する内視鏡治療後の高度狭窄への対策も同時に進み,切除+狭窄対策をセットにした治療が普及しつつある.また少なからず転移の可能性があるT1a-MM,SM癌に対してもまず内視鏡治療を行い,病理診断を行って追加治療を勧める段階的な治療戦略も受け入れられつつある.
高齢化社会を迎え,切除可能食道癌でも,手術を希望せず根治的化学放射線治療を希望した方の遺残再燃病変へのPDT治療も本邦で開発され,ステント治療も含め,内視鏡治療は,多様な背景をもつ食道癌患者への治療の大きな柱となっている.
キーワード
食道早期癌, 内視鏡治療, ESD, EMR, PDT
I.はじめに
食道癌は症状がでてから発見されると,手術,化学療法,放射線治療といった侵襲の大きな治療を受ける必要がある反面,早期に発見できると内視鏡治療により,十分根治が目指せるという特徴がある.近年胃癌検診にも内視鏡が用いられるようになり,またNarrow Band Imaging(NBI)やレーザー内視鏡などの画像強調内視鏡,拡大内視鏡,経鼻内視鏡といった早期食道癌発見のための診断ツールが開発されている.また治療においては内視鏡的粘膜下層剥離術(Endoscopic submucosal dissection:ESD)の開発・普及により,手術を回避できる症例も増加しつつある.本稿では食道癌に対する内視鏡治療の現況と展望について解説する.
II.内視鏡治療の種類
食道癌の内視鏡診断にヨード1)やトルイジンブルー2)などの色素法を用いた拾い上げが普及し,手術切除標本で得られた臨床病理学的所見から,早期癌のリンパ節転移頻度が明らかとなり,転移のない早期癌への局所治療法が求められることとなった.
1990年代に早期食道癌に対する内視鏡的粘膜切除術(Endoscopic Mucosal Resection:EMR)が開発され,オーバーチューブ法3),2チャンネル法4),キャップ法5)と手技は異なるものの,局所切除が行われ,長期的にも根治性が十分得られる事が判明し,転移のない早期食道癌への内視鏡治療は標準治療となった.手術よりも侵襲が低く,簡便で安全な治療法であるものの,EMRでは一度に切除できる大きさが規定され,およそ2㎝を超える病変の一括切除は困難であり,多分割切除が必要であった.結果として多分割切除後の局所再発が問題となり6),2000年代に病変を一括で切除できるESDが開発された7).EMRよりも手技は難しいものの,一括切除により術前診断と術後病理診断の突合せがより詳細に可能という利点がある事,またNBIや拡大内視鏡の開発により,早期食道癌の拾い上げ診断が容易となり,病変を一括切除する事の重要性が認識され,2008年に保険収載となり一気にESDが本邦で広まるとともに,より安全性の高い治療の獲得のため,治療機器の開発も盛んに行われた.消化器内視鏡の鉗子孔を通過可能な電気メスは,フックナイフ,ITナイフ,フラッシュナイフ,Dualナイフなどの先端型,ムコゼクトームなどのブレード型,クラッチカッターなどのハサミ型などがあり,それぞれの特性を生かして治療に用いられる.ムコアップなどの安定した粘膜下層の膨隆を維持する局注液,S-0クリップや糸つきクリップなどの外科医の左手ともいえる牽引デバイス,テンションをつけやすくする先端フード,切開,止血,剥離を安全に行うための高周波凝固装置なども併せて開発が進んだ.またESDの普及のための,学会,研究会でのライブやハンズオントレーニング等も一般的となり,食道癌も早期発見できれば,低侵襲な内視鏡治療ですむ病気の仲間入りを果たした.
2012年の食道癌全国登録8)によると7,999例の初回治療例中,内視鏡治療が1,407例(17.6%),化学療法and/or放射線治療が1,794例(22.4%),手術治療が4,798例(60.0%)に行われた.内視鏡治療の81.9%がESDにより行われたとされ,現在ESDは早期食道癌の初回内視鏡治療例の第一選択として本邦で広く普及している.
一方でESD後の瘢痕近傍にできた異時性多発癌や局所再発への内視鏡切除は,瘢痕組織のために局注によるliftingが困難で,ESDが難しいケースもある.そのような症例にアルゴンプラズマ凝固法(Argon plasma coagulation:APC)が有用である9).APCはアルゴンガスと高周波凝固装置を組み合わせ,組織破壊を行う方法である.電離しやすいアルゴンガスは高電圧のスプレー凝固出力によってイオン化したガスとなり,電極と組織の間に効率よく電流を流す橋渡し役になる.また発生したアルゴンプラズマビームは電流密度が低いために凝固深度は表層にとどまり,なおかつ均一である.凝固されて組織表面の抵抗の上がった所から,まだ十分に凝固されていない組織抵抗の低いところにむかってビームが延びるため,簡便かつ安全に処置を行うことが可能である.表層を焼灼し,上皮を剥がしてさらに剥離面を焼灼すれば,粘膜下層深層までの組織破壊が可能であり,2cm以内のT1a-LPMまでの病変に有効である.穿孔のリスクが極めて低く,外来でも治療が可能なため,様々な合併症や社会背景を持つ高齢者に活用できる.
進行癌に対する内視鏡治療にはステント治療がある.癌そのものを治療するわけではないため,主に緩和治療として用いられる.食道狭窄を解除するための食道ステント,食道気管・気管支瘻の治療目的の気管・気管支ステント,食道大動脈瘻を回避するための大動脈ステントなど目的に応じて様々な状況において利用される.食道狭窄や瘻孔があるが根治の可能性が残されている進行食道癌患者に放射線治療施行前にステント留置した場合は,瘻孔形成や出血などの致死的有害事象がみられたため,2017年の食道癌診療ガイドラインでは根治的放射線治療前にステントを留置しないことを強く推奨している10).
III.治療適応
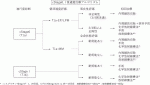
大きさ,深達度,周在性を考慮して治療適応が決定される.深達度と周在性の点では2007年の食道癌診断・治療ガイドライン11)においては,食道扁平上皮癌で転移のほとんどない臨床診断T1a-EP,LPMかつ3分の2周性の病変は内視鏡治療の絶対的適応,10%程度の転移のあるT1a-MM,T1b-SM1,もしくはT1a-EP,LPMで周在性が3分の2周性以上は相対的適応,50%程度の転移があるT1b-SM2は研究的適応とされたが,2012年,2017年とガイドラインの改訂がなされ,2017年のガイドライン12)において,ステージ0食道癌においてはcT1a-EP,LPMで4分の3周以下は内視鏡治療の適応,4分の3周以上の場合は術後の狭窄を考慮しながら内視鏡治療+拡張術,もしくは手術,化学放射線治療の選択となった.また,cT1a-MMでは耐術能を個別に考慮しながら手術,内視鏡治療,化学放射線治療の中からベストと思われる治療法を選択する.cT1bには手術,もしくは化学放射線治療が薦められる(図1).内視鏡切除後の高度狭窄への治療は従来行われてきた内視鏡的拡張術に加えてステロイドの内服13),局注14),充満法15)などが現在行われており,治療法についての多施設共同前向き試験も現在進行中である.食道表在癌への全周切除は高度狭窄を来し,その後の対応に年単位で内視鏡的拡張術を続けることもあり,以前は禁忌と考えられてきた.しかし,ステロイドの内視鏡的局注療法が狭窄への解除に応用できるようになり,現在では全周切除も容認されている.ただし,病変が広ければ,ポイントでどこかに深く入っている可能性もあり,転移のリスクも増えるため,適応拡大は慎重に行う必要がある.
ガイドライン上は食道SM癌には手術or化学放射線治療を行うのが標準治療であるが,JCOG0508「粘膜下層浸潤臨床病期Ⅰ期(T1N0M0)食道癌に対する内視鏡的粘膜切除と化学放射線併用治療の有効性に関する非ランダム化検証的試験」16)において臨床病期SMと診断した食道癌176例のうち90例(51%)が粘膜癌であったことから,食道癌のハイボリュームセンターであっても,T1a-MMとSM1を見分ける深達度診断能が決して高いといえない事が明らかとなった.SM深部浸潤癌を除きT1a-MM癌の可能性もあるSM癌に対しては,まず内視鏡切除を行って,病理組織学的評価を得てから追加治療の必要性を考える段階的な治療戦略が行われている.転移危険因子は脈管侵襲陽性,浸潤性の増殖様式,粘膜筋板浸潤部の浸潤面積等が挙げられる.転移危険因子を有する症例には身体的状況や本人家族の希望で追加治療(外科切除,化学放射線治療)を行うかどうかを相談する.追加治療拒否例が一定の頻度で存在し,再発例では頻度は少ないが原病死もある.JCOG0508臨床試験において内視鏡切除後に予防的CRTを行った「pT1a-MM以浅かつ脈管侵襲陽性かつ断端陰性」あるいは「pSM1-2かつ断端陰性」患者での3年生存率は90.7%と良好な成績が得られたと報告された16).またStageⅠ食道癌に対する食道切除術と化学放射線療法の並行群間比較試験(JCOG0502)においても根治的化学放射線療法と手術はともに安全で有効であることが学会報告17)されており,耐術能のないステージⅠ食道癌症例において化学放射線治療または内視鏡治療+化学放射線治療は有効な治療法の選択肢の一つとなりうる.しかし,同じJCOG0502試験のうちcN0と診断した211例の手術例のうち57例(27.0%)にリンパ節転移陽性であったと報告され18),術前リンパ節転移診断能が十分正確とは言えないのが課題である.食道温存治療を推進させるには,リンパ節転移の診断能をさらに向上させる必要がある.
本邦においては扁平上皮癌が約9割を占めるが,欧米ではバレット食道腺癌が増加し,本邦でも徐々に増加しつつある.食道腺癌の内視鏡治療の適応は扁平上皮癌と同様に深達度T1a-LPMまで,分化型腺癌は内視鏡治療の適応とコンセンサスが得られている.粘膜筋板に浸潤したもの,粘膜下層癌においてはリンパ節転移頻度を考慮しなければならない.
本邦の多施設共同での多数例の検討では,粘膜筋板からの浸潤距離が500µm以浅,大きさ3cm以下,脈管侵襲陰性,低分化扁平上皮癌成分なしの条件を満たせばリンパ節転移がなかったと報告されている19).今後症例の集積により,本邦の食道腺癌に対する内視鏡治療の適応が定まると思われる.
IV.合併症への対策と治療後の経過観察
出血と穿孔,狭窄がEMR/ESDの主な合併症である.2012年の食道癌全国登録によれば1,274例中出血1例(0.1%),穿孔20例(1.6%),狭窄35例(2.7%)と報告されており,94.7%は合併症なしで,安全性が高い治療であることが分かる.出血に関しては,抗凝固薬や抗血栓薬を内服している高齢者が増加しており,丁寧に止血をしながら治療を進めていく必要がある.最近は新しい高周波凝固装置の開発により,止血力の高いモードを応用することで,止血に困る事は少ない.穿孔は一たび起きると縦隔気腫,皮下気腫,気胸,膿胸などを来たし,時にドレナージ術や2週間程度の絶食,中心静脈栄養管理を必要とするが,保存的に改善することがほとんどである.治療時に粘膜欠損が4分の3周を超えると70~80%の確率で狭窄を来す.なるべく正常粘膜を残して治療することが望ましい.
また「食道癌は多発が原則」であり,同時性,異時性に生じる多発癌や,頭頸部癌,胃癌,肺癌などの他臓器重複癌を併存し易いことも知られており,併せて長期的に注意する必要がある.
V.特殊な状況での内視鏡治療
食道扁平上皮癌に対する化学放射線治療後の遺残・再燃例に対しては主にサルベージ手術が行われるが,元々耐術能の低い高齢者には負担の大きな治療である.小さな病変であればESDが可能な症例もあるが,筋層浸潤例は適応外であり,ESD困難症例も経験する.このような症例に対してサルベージ手術より負担が軽く,ESDよりも治療適応が広い治療法としてPDT(photodynamictherapy)が本邦では普及しつつある.
PDTは腫瘍親和性のある光感受性物質を投与した後,腫瘍組織にレーザー光を照射することにより光化学反応を引き起こし,腫瘍組織を変性壊死させる癌の選択的治療法である.この抗腫瘍効果は,レーザー光と光感受性物質との光化学反応によって生成される活性酸素の一種による強い酸化作用による.食道癌に対しては,放射線治療後の遺残あるいは再発例で2015年10月に保険適応になり,深達度T1~T2相当でリンパ節転移がなく,元々大動脈浸潤がないものなどが適応となる.腫瘍と結びつきやすいタラポルフィリンナトリウム(レザフィリン®)を静脈投与し,その後内視鏡を挿入し,鉗子口からプローベを用いて腫瘍にレーザー光を照射する20).組織に選択的にレーザー照射ができるため,体の負担が軽いという利点がある.注意点としては,光感受性物質の投与により,光感受性が高められた結果,光線過敏症を起こすことがあり,治療後2週間程度は日光に直接当たらないようにするなどの制限を要する.医療機器が高額のために,全国どこでも行える治療ではないが,食道癌のハイボリュームセンターを中心に徐々に普及しつつある治療法である.
VI.おわりに
食道癌に対する内視鏡治療について解説した.高齢化社会を迎え,手術や化学放射線治療を簡単に選択できない方も増加すると思われる.癌の拾い上げ診断能,転移リンパ節診断能のさらなる向上が求められるとともに,ハイリスク患者への教育,早期発見可能ながん検診システムの構築などが今度の課題である.
利益相反:なし
文献
1) 尾崎 梓:上中部食道癌診断に関する二,三の試み.千葉医会誌,47: 161, 1971.
2) 遠藤 光夫,鈴木 茂,中村 光司,他:色素散布法による食道粘膜の微細観察―特に食道病変の染色について.Progress of Digestive Endoscopy, 1: 34, 1972.
3) 幕内 博康,町村 貴郎,水谷 郷一,他:早期食道癌に対する内視鏡的粘膜切除術―EEMR-tube法の実際.胃と腸,28: 153-159, 1993.
4) )門馬 久美子,吉田 操,山田 義也,他:早期食道癌に対する内視鏡的粘膜切除の実際―2チャンネル法.胃と腸,28: 141-151, 1993.
5) 井上 晴洋,竹下 公矢,長浜 雄志,他:早期食道癌に対する内視鏡的粘膜切除の実際―EMRTとEMRC.胃と腸,28: 161-169, 1993.
6) Katada C, Muto M, Ohtsu A, et al.: Local recurrence of squamous-cell carcinoma of the esophagus after EMR. Gastrointest Endosc, 61: 219-225, 2005.
7) Oyama T, Tomori A, Hotta K, et al.: Endoscopic submucosal dissection of early esophageal cancer. Clin Gastroenterol Hepatol, 3:S67-70, 2005.
8) Tachimori Y, Ozawa S, Numasaki H, et al.: Comprehensive registry of esophageal cancer in Japan, 2012. Esophagus, 16: 221-245, 2019.
9) Kawada K, Kawano T, Nagai K, et al.: Argon plasma coagulation for local recurrence of squamous cell carcinoma of the esophagus after endoscopic mucosal resection:technique and outcome. Esophagus, 5: 27-32, 2008.
10) 日本食道学会編:食道癌診療ガイドライン.2017年版,金原出版,東京,pp97-98, 2017.
11) 日本食道学会編:食道癌診断・治療ガイドライン.2007年4月版,金原出版,東京,pp10-13, 2007.
12) 日本食道学会編:食道癌診療ガイドライン.2017年版,金原出版,東京,pp16-21, 2017.
13) Yamaguchi N, Isomoto H, Nakayama T, et al.: Usefullness of oral prednisolone in the treatment of esophageal stricture after endoscopic submucosal dissection for superficial squamous cell carcinoma. Gastrointest Endosc, 73: 1115-1121, 2011.
14) Hashimoto S, Kobayashi M, Takeuchi M, et al.: The efficacy of endoscopic triamcinolone injection for the prevention of esophageal stricture after endoscopic submucosal dissection. Gastrointest Endosc, 74: 1389-1393, 2011.
15) Shibagaki K, Ishimura N, Oshima N, et al.: Esophageal triamcinolone acetonide-filling method:a novel procedure to prevent stenosis after extensive esophageal endoscopic submucosal dissection (with videos). Gastrointest Endosc, 87: 380-389, 2018.
16) Minashi K, Nihei K, Mizusawa J, et al.: Efficacy of Endoscopic Resection and Selective Chemoradiotherapy for stageⅠesophageal squamous cell carcinoma. Gastroenterology, 157: 382-390, 2019.
17) Kato K, Igaki H, Ito Y, et al.: Parallel-group controlled trial of esophageactomy versus chemoradiotherapy in patients with clinical stage 1 esophageal carcinoma (JCOG0502). J Clin Oncol, 37: 7-7, 2019.
18) Akutsu Y, Kato K, Igaki H, et al.: The prevalence of overall and initial lymph node metastases in clinical T1N0 Thoracic Esophageal cancer:From the Results of JCOG0502, a prospective multicenter study. Ann surg, 264: 1009-1015, 2016.
19) Ishihara R, Oyama T, Abe S, et al.: Risk of metastasis in adenocarcinoma of the esophagus:a multicenter retrospective study in a Japanese population. J Gastreenterol, 52: 800-808, 2017.
20) Yano T, Kasai H, Horimatsu T, et al.: A multicenter phase Ⅱ study of salvage photodynamic therapy using talaporfin sodium (ME2906) and a diode laser (PNL6405EPG) for local failure after chemoradiotherapy or radiotheraoy for esophageal cancer. Oncotarget, 8: 22135-221344, 2017. Doi:10.18632/oncotarget.14029.
PDFを閲覧するためには Adobe Reader が必要です。