日外会誌. 121(4): 410-416, 2020
特集
食道癌診療の現況と展望
2.疫学と危険因子
|
1) 前橋赤十字病院 外科 宮崎 達也1) , 酒井 真2) , 宗田 真2) , 山地 太樹3) , 佐伯 浩司2) |
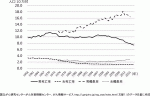
わが国における食道癌の動向は,罹患率は男性で増加傾向にあり,女性においては横ばい傾向にある.死亡率は男性においては近年減少する傾向にあり,女性においては1960年頃から一貫して減少している.
性別は5.6:1と男性に多く60~70代に好発し年齢層の約74%を占める.占居部位は胸部中部食道が最も多い.組織型は扁平上皮癌が約90%と最多であり腺癌が約5%である.治療法は手術療法が約60%と最多で,化学放射線療法(22%),内視鏡治療(18%)であった.手術症例の5年生存率はpStage0:85.2%,Ⅰ:80.2%,Ⅱ:62.3%,Ⅲ:36.1%,Ⅳa:20.1%,Ⅳb:21.6%であった.食道扁平上皮癌において,喫煙,飲酒が主要な危険因子で,喫煙飲酒の両者を併用することで危険性が増加する.日本人の20~40%にみられるアルデヒド脱水素酵素2(ALDH2)の遺伝子多型のある人で大酒家の人は特にリスクが高いと報告されている.禁煙をすること,禁酒を一定期間以上行うことで食道癌の発癌リスクは低下する.また,食道癌は重複癌の頻度が高く,特に共通した危険因子の悪性腫瘍は同時異時性に多発する.食道癌の診療を行う上でこれらの特性をよく理解して診断から治療,治療後のfollow-upをする必要がある.
キーワード
喫煙, 飲酒, 野菜, 果物, 重複癌
I.はじめに
食道癌は2017年の統計で,日本における死亡率が7番目に多く,男性では肺,胃,大腸,肝,膵,前立腺に次いで頻度の高い悪性腫瘍である.手術技術および補助療法の進歩によりその予後は改善している.わが国で最も頻度の高い食道扁平上皮癌のリスクファクターは喫煙と飲酒が主要なものとして知られている.本稿ではわが国における食道癌の疫学および危険因子について概説する.
II.わが国における食道癌の現況
わが国における食道癌の動向は,罹患率は男性で増加傾向にあり,女性においては横ばい傾向にある(図1)1)2).死亡率は男性においては近年減少する傾向にあり女性においては1960年頃から一貫して減少している(図1)1).
日本食道学会の全国調査(2012年発症症例8,003例を対象)3)によると,性別は5.6:1と男性に多く60~70代に好発し年齢層の約74%を占める.占居部位は頸部食道(Ce)2.9%,胸部上部食道(Ut)8.7%,胸部中部食道(Mt)58.2%,胸部下部食道(Lt)23.8%,食道胃接合部癌(EG,E=G,GE)5.4%で胸部中部食道が最も多い.組織型は扁平上皮癌が約90%と最多であり腺癌4.5%,バレット腺癌が1.5%であった.西ヨーロッパや米国では腺癌が多く,下部食道に多く発生している.なかでも米国では1970年代から腺癌が急速に増加し,1990年後半に扁平上皮癌と腺癌の数が逆転し腺癌が最も頻度の高い組織型となっている.わが国も,生活習慣の欧米化から食道腺癌の要因の一つである胃食道逆流症(Gastro Esophageal Reflux Disease:GERD)が増加しているが,食道腺癌の増加については米国ほど顕著な兆候はみられていない.
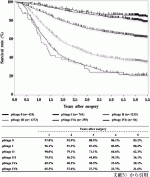
治療法は約60%が手術療法(59%が食道切除,1%が緩和手術),化学放射線療法は約22%,内視鏡治療が約18%であった.この結果は登録施設のデータでありバイアスがかかっていると考えられる.食道切除を施行した症例の5年生存率はpStage0:85.2%,Ⅰ:80.2%,Ⅱ:62.3%,Ⅲ:36.1%,Ⅳa:20.1%,Ⅳb:21.6%(ステージは食道癌取扱い規約第10版に基づく)(図2)であった.
III.危険因子
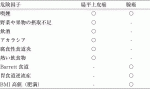
食道扁平上皮癌において,喫煙,飲酒が主要な危険因子である2)4).これは,頭頸部の扁平上皮癌とも一致する.喫煙,飲酒の両者を併用することで危険性が増加することが知られている4).一方で食道腺癌においては,GERDやそれに伴うバレット上皮,肥満や喫煙が挙げられる2).食道癌のリスク因子を表1に示す.喫煙については他の多くの悪性腫瘍の危険因子となっていることは周知の事実であるが,扁平上皮癌,腺癌ともに危険因子となっている.飲酒については2009年10月にWHOの下部組織であるIARC(International Agency for Research on Cancer)の作業部会はアルコール飲料に関連したアセトアルデヒドをGroup1の発癌物質とした5).喫煙および飲酒は食道多発癌の発生や重複癌の合併にも相関し,upper aerodigestive tact(UADT)における多中心性発癌に関与している.
また,日本人をはじめとしたモンゴロイドはアルコールの代謝産物を分解するアルデヒド脱水素酵素2(ALDH2)に遺伝子多型が20~40%に認められる.ALDH2の代謝能力が低い遺伝子多型を持つ人は少量飲酒で顔が赤くなるフラッシング反応を示す.このようなALDH2代謝能力の低いフラッシャーで大酒家は飲酒をしない人と比較して約70倍のリスクがあると報告されている6).
食道癌診療ガイドライン検討委員会では食道癌発生予防の観点から,禁煙および禁酒の推奨度を検討する目的で,システマティックレビューを行いメタアナリシスを施行した7).
喫煙者が禁煙をすることでリスク比が0.75,95%CIが0.68~0.80,p値<0.00001と有意に禁煙が食道癌発生のリスクを軽減した.サブグループ解析の結果として日本人(統合値0.65(0.51~0.83),p値<0.0004),扁平上皮癌(統合値0.60(0.50~0.72),p値<0.00001),死亡率(統合値0.73(0.63~0.84),p値<0.0001),発生率(統合値0.74(0.67~0.80),p値<0.00001)のいずれもが禁煙により有意に食道癌のリスクが低下した.腺癌に関しては(統合値0.93(0.84~1.03),p値<0.18)と統計学的には食道癌のリスクは低下しなかった.
飲酒者においては禁酒することでリスク比が1.09,95%CIが0.94~1.26,p値=0.24と有意差を認めず禁酒による予防効果を認めなかった.これは,サブグループ解析として日本人,扁平上皮癌,死亡率,発生率の各々の検討でも禁酒による食道癌の予防効果は認めなかった.そこで,5年以上の禁酒,10年以上の禁酒期間があったスタディーでのアウトカムを食道癌の発生率あるいは死亡率の低下としてメタアナリシスを再度行ったところ,5年間の禁酒期間を置いたものはリスク比が0.78,95%CIが0.66~0.93,p値=0.007.10年間ではリスク比が0.65,95%CIが0.57~0.74,p値=0.00001と食道癌の発生を抑えるには一定期間以上の禁酒が必要であることがわかった.
野菜や果物の摂取不足は食道癌のみならず,多くの癌種でリスクファクターといわれている.日本人を対象としたコホート研究において,野菜果物を多く摂取することで,食道癌のリスクが低下し,喫煙や飲酒者に関しても野菜や果物を多く摂取することで,摂取量が少ない人と比べリスクが低下することが示されている8).食道アカラシア,腐食性食道炎,熱い飲食物も食道扁平上皮癌の危険因子であり,持続する炎症が発癌を促していると考えられている.
IV.多発癌と重複癌
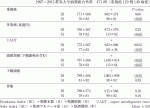
食道扁平上皮癌は同時性,異時性に癌を多発する頻度が高く,また,咽頭や喉頭,肺などのいわゆるupper aerodigestive tractに重複する癌が多いことが知られている.日本食道学会の1998年,1999年の統計9)によると食道癌の約20%に重複癌を認め,約10%が同時性,約10%が食道癌発生の前後に異時性に発生していた(表2).臓器としては,最も多いのが胃癌(38.4%)で下咽頭癌(13.3%),結腸直腸癌(12.2%),喉頭・扁桃(6.7%),肺,気管気管支(6.5%),口腔(2.8%)の順であった(表3).教室で診療した食道癌患者471例(内重複癌119例)を対象に,喫煙量としてBrinkman Index(以下,BI)飲酒量としてSake Index(以下,SI)について検討すると,重複癌ではSIが高い結果であったが,BIに統計学的な有意差には至らなかった(表4).また,食道内に癌が多発する症例は飲酒量が関与していた.重複癌の中ではUADTも飲酒量と相関があり,なかでも頭頸部癌は喫煙量飲酒量ともに多い結果であった.一方で胃癌は喫煙量飲酒量共に統計学的な有意差は認めなかった.このことから,喫煙および飲酒は食道扁平上皮癌のみならず,同時性異時性の多発癌や重複癌の危険因子である可能性が示された.


V.おわりに
わが国における食道癌の疫学および危険因子を理解し把握することは,食道癌の診断,治療方針決定そして治療後の経過観察を行う上で重要であると考えられる.また,生活習慣の欧米化や禁煙活動の普及によりこれからの食道癌の動向について注目する必要がある.
利益相反:なし
文献
1) 国立がん研究センターがん対策情報センター:がん情報サービス http://ganjoho.jp/reg_stat/index.html
2) Kitagawa Y, Uno T, Oyama T, et al.: Esophageal Cancer Practice Guidelines 2017 Edited by the Japan Esophageal Society:Part 1. Esophagus, 16(1): 1-24, 2019.
3) Tachimori Y, Ozawa S, Numasaki H, et al.: The Registration Committee for Esophageal Cancer of the Japan Esophageal Society:Comprehensive registry of esophageal cancer in Japan, 2012. Esophagus, 16: 221-245, 2019.
4) Morita M, Kumashiro R, Kubo N, et al.: Alcohol Drinking, Cigarette Smoking, and the Development of Squamous Cell Carcinoma of the Esophagus: Epidemiology, Clinical Findings, and Prevention. Int J Clin Oncol, 15(2): 126-134, 2010.
5) Secretan B, Straif K, Baanet R, et al.: WHO International Agency for Research on Cancer Monograph Working Group: A review of human carcinogens--Part E: tobacco, areca nut, alcohol, coal smoke, and salted fish. The Lancet Oncology, 10: 1033-1034, 2009.
6) Yokoyama T, Yokoyama A, Kato H, et al.: Alcohol flushing, alcohol and aldehyde dehydrogenase genotypes, and risk for esophageal squamous cell carcinoma in Japanese men. Cancer Epidemiol Biomarkers Prev, 12 (11 Pt 1): 1227-1233, 2003.
7) Miyazaki T, Kitagawa Y, Kuwano H, et al.:Decreased risk of esophageal cancer owing to cigarette and alcohol cessation in smokers and drinkers:a systematic review and meta‑analysis. Esophagus, 14: 290-302, 2017.
8) Yamaji T, Inoue M, Sasazuki S, et al.: Japan Public Health Center-based Prospective Study Group:Fruit and Vegetable Consumption and Squamous Cell Carcinoma of the Esophagus in Japan: The JPHC Study. Int J Cancer, 123(8): 1935-1940, 2008.
9) The Registration committee for esophageal cancer The Japan Esophageal Society: Comprehensive Registry of Esophageal Cancer in Japan(1998, 1999) 3rd Edition, Editorial Office The Japan Esophageal Society, Chiba, 2002.
PDFを閲覧するためには Adobe Reader が必要です。