日外会誌. 121(2): 169-176, 2020
特集
臓器移植の現状と展望
4.肝移植
|
長崎大学大学院 移植・消化器外科 原 貴信 , 江口 晋 |
わが国では年間400~450例の肝移植が行われ,その80%以上を生体肝グラフトに頼っている.1989年に第1例目が行われて以降,生体肝移植は末期肝不全に対する根治療法として確立され,脳死全肝移植と同等の成績を収めてきた.一方,脳死肝移植数は2010年の改正臓器移植法成立後も年間60例程度にとどまっており,生体ドナーに極端に偏った現状は世界的にみると特殊である.脳死下臓器提供が限られている以上,レシピエントの状況によってはマージナルグラフトを使用せざるを得ない場合もある.マージナルグラフト使用に関する一定の基準作りが求められるとともに,machine perfusion技術の確立にも期待がかかる.直近の話題として脳死肝移植のレシピエント選択基準が2019年5月15日より改正され,基本的にChild-Pughスコア10点以上での登録,登録後はMELDスコアを実施順位に反映させることとなった.また,肝細胞癌に対する適応基準が従来のミラノ基準から,5-5-500基準にも拡大された.このように開始から30年を経て移り変わってきたわが国の肝移植医療であるが,短期成績がこの30年で改善する一方,長期成績はあまり変わっていないことが指摘されている.移植肝の継続的な評価は勿論,高血圧や糖尿病,高脂血症など併存症の治療,免疫抑制剤減量による腎保護,de novo悪性腫瘍のスクリーニングが重要と考える.
キーワード
肝移植適応, 脳死肝移植, 生体肝移植
I.はじめに
世界最初の肝移植は1963年,米国ピッツバーグ大学のStarzlらによって行われ,以後欧米では脳死肝移植が末期肝不全に対する根治療法としての地位を確立するに至った.本邦では1960年代に2例の死体肝移植が行われ,その後約20年間の沈黙を経て,1989年に島根医科大学において胆道閉鎖症の小児に対して父親をドナーとした初の生体部分肝移植が実施された.また1993年には信州大学において原発性胆汁性胆管炎患者に対する世界初の成人間生体肝移植が行われた.以来本邦では生体肝移植が末期肝不全に対する根治療法としてその地位を確立してきた.一方脳死肝移植については,1997年10月に臓器移植法が制定され,1999年に信州大学にて本邦初の脳死肝移植が行われたものの,その後の脳死下臓器提供数は期待されたほど増加せず,2010年7月の改正臓器移植法の施行以降も十分とは言えない状態が続いている.結果として年間400~450例の肝移植のうち80%以上が生体肝移植により賄われている.本稿ではこれらの背景を踏まえ,日本における肝移植の現状と展望について概説する.
II.肝移植の適応
脳死肝移植の適応と生体肝移植の適応は基本的に同じであり,肝移植治療が他の治療よりも必要性・安全性・効果において有意であると判断され,肝外の重篤な感染症の合併,悪性腫瘍の併存,安全性の妨げとなる他臓器疾患など禁忌となる要素がないことが日本移植学会のガイドラインで規定されている1).生体肝移植は他のレシピエントとの公平性を考慮する必要がないことから,より適応の幅が広くなる場合がある.例えば高齢レシピエント,Child-Pugh B相当の肝硬変,ミラノ基準外の肝細胞癌,アルコール性肝硬変症例などに対する肝移植適応は,各移植施設によってもばらつきがある.
1.脳死肝移植レシピエント選択基準
2019年5月15日よりレシピエント選択基準が改正された2).以下に主な変更点を記すが,詳細については日本臓器移植ネットワークHPを参照されるか,各脳死肝移植実施施設に問い合わせをされたい.
① 優先順位
ドナーの年齢が18歳未満の場合には,選択時に18歳未満の移植希望者を優先する.またABO式血液型が一致する者が適合する者よりも優先するが,選択時に2歳未満の場合には医学的緊急性によらず,血液型不適合の待機者も候補となる.
医学的緊急性はこれまで日本肝臓学会の脳死肝移植適応評価委員会が,各脳死肝移植実施施設からの申請書類をもとに決定していたが,Status Ⅰ,Status Ⅱが定義されこの順に優先すること,またStatus Ⅱの症例はMELDスコアの高い順に優先順位を設定することが定められた.
② Status Ⅰ
緊急に肝移植を施行しないと短期間に死亡が予測される病態や疾患群を対象とし,予測余命1カ月以内の疾患・病態群.
a)急性肝不全昏睡型,遅発性肝不全(late onset hepatic failure)で昏睡Ⅱ度以上を認める症例.肝移植ガイドラインで4点以上が望ましい.登録後7日ごとに,48時間以内のデータを用いて登録を更新する.
b)尿素サイクル異常症,有機酸代謝異常症で脳症が制御できない症例.登録後は180日ごとに2点加算する.
③ Status Ⅱ
Status Ⅰ以外のすべての症例はMELDスコアの高い順に優先順位を設定する.非代償性肝不全の脳死肝移植の適応評価は当面(脳死ドナー数が年間100例以上に増加するまで)Child-Pughスコア10点以上とし,登録後はMELDスコアを実施順位に反映させる.ただし以下の疾患についてはそれぞれの病状にあわせて,Child-Pughスコア10点に満たない場合でも登録が考慮される.
a)HIV/HCV共感染
HIV/HCV重複感染者の死因の大多数が肝不全死であり,見かけ上の肝機能がChild-Pugh Aであっても門脈圧亢進症を高率に伴うこと,HCV単独感染者と比較した場合に予後が悪く肝線維化の進展が早いことが示された3).このためChild-Pughスコア7点以上で申請を行い,登録時MELDスコア16点相当とする.Child-Pughスコア10点以上の重症例はMELDスコア27点で登録とする.いずれも登録後は180日ごとに2点加算する.
b)先天性肝・胆道疾患,先天性代謝疾患
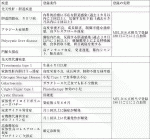
肝臓移植が治療的意義を持つ時期,患者の日常生活に障害が発生している状態および成長障害がある状態を考慮の上,評価する.表1に概要をまとめた.
c)原発性硬化性胆管炎
胆管炎を1カ月に1回以上繰り返している場合,あるいは小児例(発症年齢18歳未満)ではChild-Pughスコア7点以上で申請を行い,登録時MELDスコア16点相当とする.登録後は180日ごとに2点加算する.
d)肝細胞癌
2019年8月1日より,ミラノ基準(単発で腫瘍径5cm以内あるいは腫瘍数3個以内で腫瘍径3 cm以内,かつ脈肝浸潤,遠隔転移を認めない)を満たす症例に加え,ミラノ基準外でも腫瘍径5 cm以内かつ腫瘍個数5個以内かつAFP 500 ng/ml以下(5-5-500基準)を満たす症例に対象が拡大された.5-5-500基準は日本肝移植学会による全国調査の結果を基にしたものであり,5年再発率10%未満,5年生存率70%以上を維持しつつ,ミラノ基準と比して移植適応人数の拡大を達成している4).MELDスコアで登録し,登録後90日経過するごとに画像検査およびAFP測定を施行してミラノ基準または5-5-500基準の順守を確認したうえで,2点を加算する.
e)肝移植後グラフト機能不全
移植後1年未満の早発性と1年以降の遅発性に分けて評価する.Child-Pughスコア10点以上で申請し,登録後はMELDスコアを実施順位に反映させる.ただし肝移植後の早発性グラフト不全については,脳死肝移植ドナーが年間100例となるまでの間,残念ながら脳死肝移植の適応外となっている.
f)アルコール性肝硬変
非代償性肝硬変に準じてChild-Pughスコア10点以上で申請を行い,登録後はMELDスコアを実施順位に反映させる.ただし,申請時に遡ること18カ月の禁酒が確認されていることを絶対条件とする.これはわが国においてはhigh risk of alcoholic relapseスコアにかかわらず再飲酒が認められること,術前18カ月以上の禁酒が有意に再飲酒の頻度を低下させるとの報告による5).
III.肝移植の現状
① 脳死肝移植の現状
a)動向
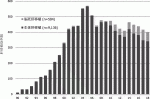
わが国では1997年に臓器移植法が施行されたが,その後も脳死下臓器提供は極めて少ない状態が続いていた.2010年に改正臓器移植法が施行され,本人の意思が不明確でも家族の書面同意があれば提供が可能となり,また15歳未満の小児からの脳死下臓器提供,親族への優先提供が可能となった.2018年末までにわが国で行われた肝移植の総数は9,643例で,その内訳は脳死移植504例,心停止移植3例,生体移植9,136例となっており,生体が約95%を占めている.図1にわが国における脳死,生体肝移植数の推移を示す.脳死肝移植数は2010年の法改正以降徐々にではあるが増加し,2017年には69例に達した.しかしながら,さらなる増加も期待された2018年は60例の施行に留まっており,厳しい状況に変わりはない.適応疾患は成人では肝細胞性疾患が最多で急性肝不全,胆汁うっ滞性疾患と続く.小児では胆汁うっ滞性疾患と代謝性疾患がほぼ同数で,急性肝不全がこれに続いている6).
b)成績
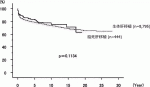
2017年末までの集計では,脳死肝移植後の患者生存率は1年89%,3年85%,5年83%,10年75%,15年71%である(図2).脳死肝移植では小児と成人の成績に明らかな差は認められない6).
c)マージナルドナーからの肝移植
脳死下臓器提供数が限られている現状から,わが国でも移植に際して少なからずリスクがあると考えられるマージナルドナー,あるいはextended criteria donorからの移植が避けられない状況にある.マージナルドナーとされる要因は,グラフト機能障害の危険因子と疾患伝播の危険因子の二つに大きく分けられる.マージナルドナーの基準としてEurotransplantでは年齢>65歳,人工呼吸器装着下でのICU滞在>7日,BMI>30,脂肪変性>40%,Na>165 mmol/l,ALT>105 U/l,AST>90 U/l,T-Bil>3 mg/dlの1項目以上に該当するものとしている7).マージナルグラフトの使用により待機患者の死亡数減少が期待されるが,一方でドナー条件が不良であればレシピエントの死亡率上昇も報告されている8)ことから,特にバックアップとなるグラフトの確保が難しい本邦においてはマージナルグラフトの使用についての一定の基準作成が急務である.
② 生体肝移植の現状
a)動向
1989年の開始以来右肩上がりで増加してきた生体肝移植数は2006年に初めて減少に転じ,直近では年間350例前後で推移している.結果として全体の肝移植数はこの数年減少傾向にある(図1).成人では肝細胞性疾患と肝細胞癌がほぼ同数で,代謝性疾患,急性肝不全と続く.小児では胆汁うっ滞性疾患が70%以上を占めている.全体的な傾向としてB型・C型肝炎ウイルス性肝硬変の減少と,アルコール性肝硬変の増加が近年の特徴となっている6).
b)成績
2017年末までの集計では,生体肝移植後の患者生存率は1年85%,3年81%,5年79%,10年73%,15年69%であり,脳死肝移植の成績と同等である(図2).年齢別でみると,生体肝移植では小児の成績が成人よりも有意に良好となっている.疾患別でみると急性肝不全,肝細胞性疾患,腫瘍性疾患が有意に成績が悪くなっている6).
c)生体ドナー
2017年末までにわが国では8,793名の生体ドナーに肝採取術が施行されている.残念ながらこれまでに死亡例が1例,生命に危険が及ぶ重篤な合併症2例が報告されている.ドナー年齢は30代が最多で,次いで20代であり,最年少は17歳,最高齢は70歳となっている.ドナーの続柄は小児では両親が95%であるのに対し,成人では子供(44%),配偶者(24%),兄弟姉妹(18%),両親(10%)の順である.ドナー条件は日本肝移植学会の生体肝提供手術に関する指針を順守することが求められるが,グラフト選択やドナー併存疾患への対応など各移植施設により異なる点も多い.近年ではドナー肝採取においても腹腔鏡下あるいは上腹部正中Hybrid手術が数多く実施され,安全性を保ったうえでドナーへの侵襲を軽減する取り組みが行われている9)10).
IV.今後の展望
① Machine Perfusion
現在,ドナー臓器は冷却した臓器保存液により灌流後摘出され,移植するまでの間氷冷保存(4℃)されている.これにより臓器の代謝を抑制することができる一方,臓器内に蓄積された障害物質による虚血再灌流障害が問題となる.Machine Perfusionは摘出した臓器を人工心肺に接続して酸素と栄養とを循環させるもので,これを用いることで代謝により発生する障害物質や炎症物質の蓄積を回避し,保存中のダメージの軽減,保存時間の延長が期待されている.肝臓においては低温灌流と恒温灌流の二つの方法が主流となっており,低温灌流では活性酸素を低下させてミトコンドリアを保護し,肝細胞内のATP量を維持することで虚血再灌流障害の軽減が期待される11).恒温灌流では代謝を維持することで灌流中に臓器機能をあらかじめ評価できるという利点がある.灌流中に様々な薬剤を投与することも可能であり,臓器の機能改善にも期待が寄せられている.Machine Perfusionは欧米において既に臨床試験が進んでおり,2018年に発表された恒温灌流群と単純冷保存群とのRCTでは,前者においてグラフト障害の軽減,臓器不使用率の低下,早期臓器機能障害の低下が示された12).費用の問題はあるものの,心停止ドナーからの提供を含むマージナルグラフトではいち早くMachine Perfusionを開始することで,臓器の状態を整えてから待機的に移植することが近い将来可能となるかもしれない.
② 肝移植後長期成績
移植症例の適切な選択,ドナー評価,臓器保存技術,免疫抑制剤の進歩,周術期管理の充実などにより肝移植後の短期成績は劇的に改善した13).一方,長期成績についてはあまり改善がみられていない.RanaらはUnited Network for Organ Sharing(UNOS)のデータベースを用いて移植後1年以上生存した111,673例を解析し,1987年から2016年までの間に長期生存率がほとんど変わらなかったと報告している14).死因別では16.4%が悪性腫瘍,11.5%がグラフト不全,10.5%が感染症により死亡していることから,長期にわたる免疫抑制剤の内服が影響を及ぼしていると考察している.肝移植レシピエントにおけるde novo悪性腫瘍の発症リスクは,免疫抑制剤の長期使用により一般人口比で2~3倍に上昇することが知られており15),本邦におけるアンケート調査の結果では,臓器移植後のde novo悪性腫瘍として移植後リンパ増殖性疾患(PTLD)が最も多く,次いで肺癌,大腸癌,胃癌の順となっている16).長崎大学では定期的なスクリーニングによる積極的な介入がde novo悪性腫瘍の治療成績向上に重要と考え,外来での診察と各自治体による癌検診に加えて年1回の検査入院を導入し,胸腹部CT,上下部消化管内視鏡,肝生検,骨密度測定を行っている17).2019年4月までに当科で施行した肝移植症例297例中,de novo悪性腫瘍を26例(8.8%)に認めており,内訳はPTLD6例,胃癌・大腸癌各3例,皮膚癌・口腔癌・膵癌・乳癌各2例,食道癌・咽頭癌・腎癌・ランゲルハンス組織球症が各1例,その他2例であった.固形癌の症例では肺癌,食道癌,口腔癌,膵癌をそれぞれ1例失っているが,他は無再発で生存しておりスクリーニングによる早期発見,治療が一定の効果を上げているものと考える.
また,肝移植後の免疫抑制剤は現在カルシニューリン阻害剤(CNI)が中心であるが,この副作用としての腎機能障害も看過できない問題となっている.Stage 4以上のChronic kidney disease(CKD)(GFR<30 ml/min/1.73 m2)は移植後5年以内に約18%,10年以内に約25%発生し,腎障害合併例での移植後死亡リスクは約4倍になると報告されているためである18).CKDの発生を抑えるためには,高血糖や高血圧の是正に加えてCNIの減量が重要である.ACE阻害剤やアンギオテンシンⅡ受容体拮抗薬の使用はCNIの腎毒性に有用とされている19).また,ミコフェノール酸モフェチル併用下でのタクロリムスの減量は腎機能を改善し,拒絶も増加しなかったことが報告されている20).腎毒性を持たないとされるm-TOR阻害剤への変更も腎機能の維持に有効と考えられる21).このように長期予後改善のためには肝機能のみならず腎機能,高血圧,de novo悪性腫瘍,さらには糖尿病,脂質代謝異常や骨粗鬆症への対策など幅広い管理が必要であり,関係各科との連携が今後ますます重要になると考えている.
V.おわりに
わが国における肝移植の現状と展望を述べた.脳死下臓器提供数の人口100万人あたりの提供数が1を下回っている現状22)を変えることが最優先事項であり,解決すべき問題は多い.提供数増加のための工夫として,院内コーディネーターの設置および権限強化,オプション提示にかかわる専門組織の構築,opt-out方式(臓器提供をしない旨の意思表示をしなければ自動的にpotential donorとなる)の導入,potential donor報告の義務化,インセンティブ方式,専門職の教育および育成など,脳死下臓器提供先進国の制度に倣い,多岐にわたる方策を検討し続ける必要がある23).
利益相反:なし
文献
1) 日本移植学会:生体肝移植ガイドライン. http://www.asas.or.jp/jst/pdf/guideline_001kanishoku.pdf(2019.9.1確認).
2) 日本臓器移植ネットワーク:肝臓移植希望者(レシピエント)選択基準. http://www.jotnw.or.jp/jotnw/law_manual/pdf/rec-liver.pdf(2019.9.1確認).
3) Eguchi S, Takatsuki M, Soyama A, et al.: Analysis of the hepatic functional reserve, portal hypertension, and prognosis of patients with human immunodeficiency virus/hepatitis C virus coinfection through contaminated blood products in Japan. Transplant Proc, 46: 736-738, 2014.
4) Shimamura T, Akamatsu N, Fujiyoshi M, et al.: Expanded living-donor liver transplantation criteria for patients with hepatocellular carcinoma based on the Japanese nationwide survey: the 5-5-500 rule - a retrospective study. Transpl Int, 32: 356-368, 2019.
5) Egawa H, Ueda Y, Kawagishi N, et al.: Significance of pre-transplant abstinence on harmful alcohol relapse after liver transplantation for alcoholic cirrhosis in Japan. Hepatol Res, 44: 428-436, 2014.
6) 日本肝移植研究会:肝移植症例登録報告.移植,52:134-147,2017.
7) Eurotransplant manual, Chapter 9 The Donor, P18. https://www.eurotransplant.org/cms/mediaobject.php?file=H9+The+Donor%2C+May+20181.pdf (2019.9.1確認).
8) Cameron AM, Ghobrial RM, Yersiz H, et al.: Optimal utilization of donor grafts with extended criteria: a single-center experience in over 1000 liver transplants. Ann Surg, 243: 748-753, 2006.
9) Eguchi S, Soyama A, Hara T, et al.: Standardized hybrid living donor hemihepatectomy in adult-to-adult living donor liver transplantation. Liver Transpl, 24: 3363-3368, 2018.
10) Shirabe K, Eguchi S, Okajima H, et al.: Current Status of Surgical Incisions Used in Donors During Living Related Liver Transplantation-A Nationwide Survey in Japan. Transplantation, 102: 1293-1299, 2018.
11) Quillin RC 3rd, Guarrera JV: Hypothermic machine perfusion in liver transplantation. Liver Transpl, 24: 276-281, 2018.
12) Nasralla D, Coussios CC, Mergental H, et al.: A randomized trial of normothermic preservation in liver transplantation. Nature, 557: 50-56, 2018.
13) Charlton MR: Roadmap for improving patient and graft survival in the next 10 years. Liver Transpl, 22: 71-78, 2016.
14) Rana A, Ackah RL, Webb GJ, et al.: No Gains in Long-term Survival After Liver Transplantation Over the Past Three Decades. Ann Surg, 269: 20-27, 2019.
15) McCaughan GW, Vajdic CM: De novo malignant disease after liver transplantation? Risk and surveillance strategies. Liver Transpl, 19 (Suppl 2):S62-S67, 2013.
16) Miyazaki T, Sato S, Kondo T, et al.: National survey of de novo malignancy after solid organ transplantation in Japan. Surg Today, 48: 618-624, 2018.
17) 原村 智子,曽山 明彦,高槻 光寿,他:生体部分肝移植後de novo悪性腫瘍の検討.移植,48:395-399,2013.
18) Ojo AO, Held PJ, Port FK, et al.: Chronic renal failure after transplantation of a nonrenal organ. N Engl J Med, 349: 931-940, 2003.
19) Durand F: How to improve long-term outcome after liver transplantation? Liver Int, 38 (Suppl 1): 134-138, 2018.
20) Boudjema K, Camus C, Saliba F, et al.: Reduced-dose tacrolimus with mycophenolate mofetil vs. standard-dose tacrolimus in liver transplantation:a randomized study. Am J Transplant, 11: 965-976, 2011.
21) Saliba F, Duvoux C, Gugenheim J, et al.: Efficacy and Safety of Everolimus and Mycophenolic Acid With Early Tacrolimus Withdrawal After Liver Transplantation:A Multicenter Randomized Trial. Am J Transplant, 17: 1843-1852, 2017.
22) IRODaT Newsletter 2019-March. http://www.irodat.org/img/database/pdf/IRODaT%20Newsletter%202019-March.pdf(2019.9.1確認).
23) Soyama A, Eguchi S: The current status and future perspectives of organ donation in Japan:learning from the systems in other countries. Surg Today, 46: 387-392, 2016.
PDFを閲覧するためには Adobe Reader が必要です。