日外会誌. 121(1): 54-60, 2020
特集
蛍光ガイド手術の現状と展望
8.乳癌腋窩センチネルリンパ節蛍光マッピングの臨床応用
|
関西医科大学附属病院 乳腺外科 杉江 知治 |
乳癌腋窩センチネルリンパ節生検は,腋窩手術の標準術式となっている.センチネルリンパ節の転移状況は,腋窩リンパ節郭清の適応だけでなく,術後の全身薬物療法の適応を考慮するうえで重要な情報となる.センチネルリンパ節の同定法は放射線同位元素(radioisotope:RI)を用いるRI法や色素を加えた併用法が標準手技となっている.しかし,RIの使用にあたっては核医学のある施設に限られるなどの欠点がある.そのなかで,わが国で開発されたインドシアニングリーンと近赤外線イメージングシステムを用いた蛍光マッピングはreal-timeにリンパ流を確認し,蛍光シグナルを有するセンチネルリンパ節を摘出する蛍光ガイド手術を可能にした.これまでの臨床試験の結果から,この蛍光法はRI法と同等の高い同定率を示すことが明らかとなり,保険収載によって,現在では,RI法にならぶ標準手技となっている.現在,プロジェクションマッピングを利用した新規画像システムなどの開発がすすめられている.
キーワード
乳癌, センチネルリンパ節, インドシアニングリーン, 蛍光マッピング
I.はじめに
乳癌手術における腋窩リンパ節郭清は,局所制御に加え,腋窩リンパ節の転移状況を把握し,術後の薬物療法や放射線治療の適応を決めることを目的に.腋窩リンパ節転移陽性だけでなく転移陰性乳癌においても積極的に行われてきた.しかし,腋窩リンパ節郭清は,術後のリンパ浮腫,知覚異常,挙上困難などの合併をきたしQOLの低下をまねいていた.センチネルリンパ節は「腫瘍細胞が,原発巣からのリンパの流れにそって最初に到達する1個あるいは数個のリンパ節」と定義され,センチネルリンパ節は腋窩の転移状況を的確に反映すると考えられている.センチネルリンパ節に転移がなければ,腋窩リンパ節郭清を省略するセンチネルリンパ理論は広く受け入れられ,センチネルリンパ節生検は,現在,乳癌腋窩手術の標準術式となっている1).
色素を用いた色素法や放射線同位元素(radioisotope:RI)を用いたRI法,両者を用いる併用法は,標準的なセンチネルリンパ節の同定法として広く普及している2).しかし,色素法は導入が簡便で,コストが低いなどの長所はあるが,センチネルリンパ節の同定率が相対的に低く,その手技には熟練を要すことが指摘されている.一方,RI法は,手技が簡便で高い同定率を示すが,核医学施設が必要などの制約があり,これらの施設のない中小病院での実施は困難となっている.
RIを用いないセンチネルリンパ節の同定法として,2005年に鍛ら3)は,インドシアニングリーン(indocyanine green:ICG)をもちいた蛍光法を発表した.ICGは,肝機能や循環機能の検査に用いられる色素であるが,650~900nmの近赤外線領域(optic window)で,励起光を受けると蛍光を発する.術中に近赤外線(Near infrared:NIR)イメージングシステムを用いることによって,real-timeに腋窩にむかう皮下のリンパ流を観察でき,リンパ流が収束する部位で蛍光を発するセンチネルリンパ節を同定できる.このシステムは,画像化に電離放射線を用いないことから核医学施設のない中小医療施設でも実施可能な方法といえる.
本稿では,乳癌における腋窩リンパ節の蛍光マッピングの手技を紹介するとともに,その臨床的有用性について文献的考察を加え解説する.
II.ICGとNIRイメージングシステムの準備
ICGは,溶解度が5~10mg/mlの両親媒性の色素であり,血管内の血清タンパク(リポタンパク,アルブミン)と結合すると流体力学的径は増加するが,この径の大小が,リンパ節内の取り込みや拡散に関与している.ICG濃度と蛍光強度とは直線的な相関を示さず,高濃度のICGではquenching効果によって蛍光強度はむしろ減弱する.センチネルリンパ節の蛍光マッピングに用いるICGの至適濃度については一定の見解は得られていない.本邦では,鍛ら3)が最初に報告した0.5%ICG(5mg/ml;6.4mM)が広く用いられている.しかし,ICGをヒト血清アルブミンと非共有結合させたICG:HASでの検討では,400~800μMでもっとも高い信号バックグラウンド比を示しており4),これは,0.5% ICGの約10分の1になっている.蛍光強度は,ICG濃度だけでなく注入液量にも影響するが,われわれの経験では0.5% ICGを1mL注入しても良好な信号バックグラウンド比が得られている.
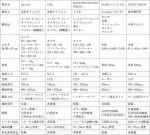
ICGを用いた蛍光マッピングには,NIRイメージングシステムが必要となる.現在,乳癌のセンチネルリンパ節生検に利用可能なシステムを表1にまとめた.浜松ホトニクス株式会社製のphoto dynamic eye(PDE)およびpde-neo,ミズホ株式会社製のHyperEye Medical System Handyはハンドヘルド型のコンパクトで軽量なシステムである.アーム固定型では,SPY蛍光イメージングシステム(Novadaq Technologies)やLIGHTVISION(株式会社島津製作所)などがある.各装置によって大きさ,励起波長,撮影画像,撮影距離,フォーカス調整などがことなるため,利便性や手術室のスペースによって機種を選択する必要がある.
III.手術手技
ICGは,腫瘍の位置にかかわらず,乳輪外縁の皮下または真皮内に注入する.どちらを選択するかは,術者の経験による.乳輪下および腫瘍周囲にICGを注入する報告も散見されるが,両者のリンパ網はほぼ一致して腋窩にむかうことやほとんどの偽陰性が腋窩リンパ節に認められることから,ICGを乳輪下にのみ注入することは妥当と思われる5).また,色素を併用する場合もあるが,後述するようにICGを蛍光法として使用した場合には,別の色素を併用する必要はない.
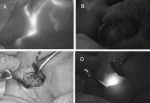
注入してしばらくマッサージを行ったのち,NIRカメラで術野を観察すると,乳輪から腋窩に向かう皮下リンパ管が蛍光シグナルとして観察される(図1A).ときに血管が描出されることがあるが,血管の流速はリンパ管にくらべて速いため,蛍光シグナルがwashing outされることでリンパ管との鑑別は容易である.皮下リンパ管は数本に分かれて観察されることがあるが,腋窩に近づくと最終的に1本に合流して大胸筋外縁で消失することが多い.センチネルリンパ節は,消失点よりやや頭側の腋窩腔にあるが,近赤外線の深達度が1~2cm程度であることから,プラスチック半球等でこの領域の皮膚を圧迫することによって,体表からセンチネルリンパ節の蛍光シグナルを確認できるようになる(図1B).
リンパ管が途絶した部位から約2cm頭側に4cm程度の皮膚切開をおき,皮下脂肪を丁寧に剥離し,大胸筋から連続する浅系筋膜確認する(図1C).続いて浅系筋膜を切開すると脂肪組織は容易に引き出せるようになり,ここで,NIRカメラで観察すると強い蛍光シグナルを確認できる(図1D).さらに小胸筋から連続する深系筋膜を切開して腋窩腔に入り,脂肪組織を引き出すと,そのなかに通常1~2個のセンチネルリンパ節を確認できる.リンパ管に沿って乳房にもっとも近いリンパ節を第一リンパ節とし,遠位にむかって順次リンパ節を摘出してゆく.リンパ節を摘出したあと,創部を再度確認し,蛍光を発するリンパ節が残っていないかを確認する.また,蛍光シグナルがなくても,触診で腫大したリンパ節を認めれば,これをセンチネルリンパ節として摘出する.摘出したリンパ節は,蛍光の有無を確認したあと,術中迅速病理診断やOne-Step Nucleic Acid Amplification(OSNA)法によって転移の有無を確認する.
IV.臨床成績
2005年に鍛ら3)が初めてICGとNIRイメージングシステムを用いたセンチネルリンパ節生検を報告して以来,RI法および色素法とICGを用いた蛍光法の比較試験の結果が報告されている(表2).色素とICGを併用した多賀谷ら6)の報告では,色素法の同定率が92%であったのに対して蛍光法は100%であった.標準的な同定法であるRI法と蛍光法を比較したMurawaら7)の報告では,蛍光法によるセンチネルリンパ節の同定率が100%とRI法の85%と比較して良好であった.一方,北条ら8)の報告では,センチネルリンパ節の同定率は,RI法100%, 蛍光法93.1%とむしろ蛍光法の同定率が劣る結果となっていた.Wishartら9)は,RI,色素,ICGの3者を併用しセンチネルリンパ節の同定率を比較した結果,RI法91.3%,色素法99%,蛍光法100%と蛍光法は他の2法にくらべて同定率は高かったが,摘出リンパ節個数は,RI法1.5個,色素法1.84個,蛍光法1.93個と蛍光法で多い傾向にあった.色素法と蛍光法を比較した過去の臨床試験の結果,センチネルリンパ節の同定率は,色素法が65.4~96%,蛍光法が99.3~100%と蛍光法で高く,前向き試験10)においても蛍光法は同定率において色素法を有意に上回っていた(99% vs 78%,p<0.001).Ahmedら11)によるメタ解析でも,蛍光法の同定率は色素法と比べ有意に高いことが報告されている(オッズ比[OR]18.37,95%信頼区間[CI]:8.63~39.10).以上のことから蛍光法は色素法にまさるセンチネルリンパ節の同定法であるといえ,ICGを蛍光法として使用する場合に,別の色素を併用する必要はないといえる.
RI法と蛍光法を比較した過去の研究は,いずれも単施設による小規模なものが多い.そのなかで,われわれが行った前向き多施設共同試験12)では,蛍光法の同定率は97.2%とRI法の97.0%と同等であり,RIとICGの併用法は,RI単独法にくらべて有意に高い同定率を示していた(99.8% vs 97.0%,p<0.001).さらに,最近のメタ解析13)でも,同定率に関してRI法と蛍光法に有意差を認めなかったが(OR,1.29;95%CI,0.87~1.90),転移陽性センチネルリンパ節の同定に限れば,蛍光法がRI法を上回る傾向にあった(OR 1.87,95% CI,1.00~3.49).これらの結果から,蛍光法はRI法とならび,すぐれたセンチネルリンパ節の同定法といえる.
過去の研究のなかには,センチネルリンパ生検のあとに腋窩リンパ節郭清を行い,センチネルリンパ節生検の感度,特異度,偽陰性率を検討したものがいくつか含まれている.Guoら14)は,ICG法の偽陰性率は12%であったが色素と併用することによって4.0%と改善したと報告している.また,Tohら15)の報告でも,色素にICGを併用することによって,偽陰性率は11.1%から3.4%に改善していた.蛍光法によるリンパ節摘出個数は,1.73から5.3個であり,RI法の1.35から2.3個と比較して多い傾向にある.蛍光による摘出個数の増加は患者の害になるという意見もあるが,われわれが行った検討12)では,RI法および蛍光法の摘出リンパ節個数は,それぞれ1.7個および2.3個であり,蛍光法の利便性を考慮すると臨床上許容できる範囲と考えられる.

V.安全性と予後
ICGの添付文書によると,投与症例で報告された副作用は0.17%であり,主な副作用はショック(0.02%),悪心・嘔吐(0.08%),発熱・熱感(0.02%)とされている.しかし,通常の肝機能検査や循環機能検査で使用する量にくらべ,センチネルリンパ節生検に使用する量は1回あたり5mgと少ないことや,過去の臨床試験においてもグレード3以上の重篤な有害事象は報告されていないことなどから,蛍光法の安全性は高いといえる.ただし,ICGにはヨウ素を含有しているため,ヨード過敏症既往のある場合や,妊娠中および授乳中の場合には,投与に関する安全性は確立していないことから,投与を避けることが望ましい.
蛍光法よるセンチネルリンパ節生検後の予後に関して,Hirch16)やTohら15)の報告では,それぞれの観察期間中央値が4.7年,30.5カ月で,腋窩リンパ節の再発を認めなかった.一方,井上ら17)は,38カ月の観察期間中央値(4.4~87.7カ月)で711例中2例(0.4%)に腋窩リンパ節を認めたことを報告している.最も規模の大きい前島ら18)によるコーホート研究では,蛍光法を受けた1,132例において,観察期間中央値41カ月(21~117カ月)での腋窩リンパ節再発は6例(0.53%)に過ぎず,これは,センチネルリンパ節生検陰性の乳癌における腋窩再発率0.6%19)と同じく低いものであった.また,リンパ浮腫など過剰リンパ節摘出に起因すると考えられる有害事象も過去の報告と差はなかった.以上より蛍光法は,安全性,長期予後の面でも良好な成績をおさめている.
VI.新規画像システムの開発
NIRイメージングシステムを用いて,より効率的な蛍光ガイド手術を実現するため,新しい画像装置の開発もすすめられている.Projection mapping技術を応用して,術野に蛍光画像を投影するmedical imaging projection system(MIPS)が開発されている.高田ら20)は,MIPSを用いたセンチネルリンパ節生検を行い,センチネルリンパ節同定率100%,摘出リンパ節個数の中央値3個(1~7個)であったことを報告している.このシステムでは,無影灯を使用することなくreal-timeな蛍光ガイド手術が可能となることから,今後の実用化が期待される.
VII.おわりに
NIRイメージングによる腋窩センチネルリンパ節の蛍光マッピングは,同定率だけでなく,長期予後と安全性の観点からもRI法に代わるセンチネルリンパ節の同定法といえる.
2018年の診療報酬改定で蛍光法は保険収載され,わが国で開発された技術が13年をへてようやく標準手技として臨床現場で活用できるようになった.ICGを用いた蛍光イメージングは,血流評価や腫瘍の可視化などにも応用されており,この蛍光ガイド手術が,他領域においても,標準治療として実施されることを期待したい.
利益相反:なし
文献
1) Lyman GH, Somerfield MR, Bosserman LD, et al.: Sentinel lymph node biopsy for patients with early-stage breast cancer:American society of clinical oncology clinical practice guideline update. J Clin Oncol, 35: 561-564, 2017.
2) Kim T, Giuliano AE, Lyman GH: Lymphatic mapping and sentinel lymph node biopsy in early-stage breast carcinoma:a metaanalysis. Cancer, 106: 4-16, 2006.
3) Kitai T, Inomoto T, Miwa M, et al.: Fluorescence navigation with indocyanine green for detecting sentinel lymph nodes in breast cancer. Breast Cancer, 12: 211-215, 2005.
4) Mieog JS, Troyan SL, Hutterman M, et al.: Toward optimization of imaging system and lymphatic tracer for near-infrared fluorescent sentinel lymph node mapping in breast cancer. Ann Surg Oncol, 18: 2483-2491, 2011.
5) Sugie T: Controversy of axillary diagnosis and treatment. In Toi M and Winer EP (eds), Local and systemic management of primary breast cancer, Kyoto University Press, Kyoto, pp61-71, 2010.
6) Tagaya N, Yamazaki R, Nakagawa A, et al.: Intraoperative identification of sentinel lymph nodes by near-infrared fluorescence imaging in patients with breast cancer. Am J Surg, 195: 850-853, 2008.
7) Murawa D, Hirche C,Dresel S, et al.: Sentinel lymph node biopsy in breast cancer guided by indocyanine green fluorescence. Br J Surg, 96: 1289-1294, 2009.
8) Hojo T, Nagao T, Kikuyama M, et al.: Evaluation of sentinelnode biopsy by combined fluorescence and dye method and lymph flow for breast cancer. Breast, 19: 210-213, 2010.
9) Wishart GC, Loh SW, Jones L, et al.: A feasibility study (ICG-10) of indocyanine green (ICG) fluorescence mapping for sentinel lymph node detection in early breast cancer. Eur J Surg Oncol, 38: 651-656, 2012.
10) Sugie T, Sawada T, Tagaya N, et al.: Comparison of the indocyanine green fluorescence and blue dye methods in detection of sentinel lymph nodes in early-stage breast cancer. Ann Surg Oncol, 20: 2213-2218, 2013.
11) Ahmed M, Purushotham AD, Douek M: Novel techniques for sentinel lymph node biopsy in breast cancer:a systematic review. Lancet Oncol, 15:e351- e362, 2014.
12) Sugie T, Kinoshita T, Masuda N, et al.: Evaluation of the clinical utility of the ICG fluorescence method compared with the radioisotope method for sentinel lymph node biopsy in breast cancer. Ann Surg Oncol, 23: 44-50, 2016.
13) Sugie T, Ikeda T, Kawaguchi A, et al.: Sentinel lymph node biopsy using indocyanine green fluorescence in early-stage breast cancer:a meta-analysis. Int J Clin Oncol, 22: 11-17, 2017.
14) Guo W, Zhang L, Ji J, et al.: Evaluation of the benefit of using blue dye in addition to indocyanine green fluorescence for sentinel lymph node biopsy in patients with breast cancer. World J Surg Oncol, 12: 290-294, 2014.
15) Toh U, Iwakuma N, Mishima M, et al.: Navigation surgery for intraoperative sentinel lymph node detection using Indocyanine green (ICG) fluorescence real-time imaging in breast cancer. Breast Cancer Res Treat, 153: 337-344, 2015.
16) Hirche C, Murawa D, Mohr Z, et al.: ICG fluorescence-guided sentinel node biopsy for axillary nodal staging in breast cancer. Breast Cancer Res Treat, 12: 373-378, 2010.
17) Inoue T, Nishi T, Nakano Y, et al.: Axillary lymph node recurrence after sentinel lymph node biopsy performed using a combination of indocyanine green fluorescence and the blue dye method in early breast cancer. Breast Cancer, 23: 295-300, 2016.
18) Maeshima Y, Takahara S, Yamauchi A, et al.: Usefulness of sentinel lymph node biopsy by indocyanine green fluorescence method for cN0 breast cancer patients. Cancer Res, 79(4Suppl):Abstract nr P3-03-21, 2019.
19) Matsen C, Villegas K, Eaton A, et al.: Late axillary recurrence after negative sentinel lymph node biopsy is uncommon. Ann Surg Oncol, 23: 2456-2461, 2016.
20) Takada M, Takeuchi M, Suzuki E, et al.: Real-time navigation system for sentinel lymph node biopsy in breast cancer patients using projection mapping with indocyanine green fluorescence. Breast Cancer, 25; 650-655, 2018.
PDFを閲覧するためには Adobe Reader が必要です。