日外会誌. 121(1): 48-53, 2020
特集
蛍光ガイド手術の現状と展望
7.呼吸器外科領域における研究と展望
|
鹿児島大学病院 呼吸器外科 武田 亜矢 , 上田 和弘 , 梅原 正 , 前田 光喜 , 青木 雅也 , 永田 俊行 , 横枕 直哉 , 狩集 弘太 , 佐藤 雅美 |
CT検診の普及によりスリガラス陰影を主体とした小型肺癌の発見率は増加し,一方で人口の高齢化により高齢者肺癌手術症例の比率は顕著に増加した.結果として,切除範囲やアプローチの縮小化を目指した低侵襲手術の需要が増している.原発性肺癌に対する標準術式は肺葉切除と肺門縦隔リンパ節郭清であるが,一定の条件を満たした症例に対して肺部分切除,区域切除,選択的リンパ節郭清といった縮小手術が日常臨床で行われている.そこで工夫しなければならない点が幾つかあり,ICG蛍光法が重要な役割を果たしている.
まず,触知困難な小型病変の同定である.従来のVATSマーカーによる経皮的マーキングでは空気塞栓のリスクを伴うが,ICG蛍光法は肺を穿刺することなく病変を同定し得る方法である.比較的深部の病変も同定可能になり,サージカルマージン確保の観点からもその有用性が期待されている.次に,区域切除における切離ラインの決定にICG蛍光法が用いられている.従来の選択的ジェット換気による含気虚脱ラインによる同定は,胸腔鏡下手術において視野の妨げになることがあるが,ICG蛍光法では肺を含気させる必要がなく,手技も簡便である.そして,リンパ節郭清の個別化においてICG蛍光法が期待される.肺はセンチネルリンパ節の同定が解剖学的に困難であり,その概念が確立してない.ICG蛍光法を用いた最新の肺のリンパ節マッピングについて本文中で触れる.
キーワード
ICG蛍光法, ナビゲーション手術, 区域切除, センチネルリンパ節, 胸膜リンパ流
I.はじめに
最新の2016年日本胸部外科学会学術調査年次報告1)によると,本邦では年間42,482例の原発性肺癌に対して手術が行われ,80%がI期肺癌であった.スリガラス陰影を主体とした早期肺癌の発見率が増加したことが大きな要因と思われる.一方,年齢別では54%が70歳以上,さらには12.5%が80歳以上の高齢者であった.このような背景に伴って,肺の切除範囲の縮小化やリンパ節郭清範囲の縮小化を意図した縮小手術が行われる機会が増えつつある.縮小手術の実施においては,標準手術に対する縮小手術の有用性(JCOG1211, JCOG1413, JCOG0804/WJOG4507L)あるいは非劣性(JCOG0802/WJOG4607L)を証明する臨床試験の結果が待望される.一方,臨床現場では症例毎のリスクベネフィット評価に基づいて手術術式が決定されている.これら縮小手術を行う上で工夫しなければならない点が幾つかあるが,ICG蛍光法が重要な役割を果たしている.
II.ナビゲーション手術
気管支鏡検査は,肺の解剖学的特性により末梢病変を直接観察することができないため,その診断率は消化器内視鏡検査のそれに劣る.CT検診の普及により,小型の肺結節が発見され,胸腔鏡下生検が行われる頻度は相対的に増加した.胸腔鏡下手術での触診は1本の検指に委ねられるために病変の同定が困難となることがある.病変の局在同定においては,術前に非透視マーカー,色素,造影剤,放射性同位元素などを用いて,CTガイド下に経皮的マーキング2)を行うが,気胸のリスクがあり,稀ではあるが空気塞栓3)により致死的転帰をたどる可能性もある.また,病変位置によっては穿刺不可能な場合があったり,複数病変に対してマーキングを行う際に気胸を起こすと手技を断念せざるを得なかったりする.経皮的マーキングの代替法として経気管支鏡下マーキングがあり,安全ではあるものの煩雑であり正確性に問題がある.この欠点を補う方法として仮想気管支鏡や電磁場誘導気管支鏡(ENB)4)といった気管支鏡ナビゲーションを用いる工夫がされている.両アプローチともICG蛍光法を用いると,深さ2cm以内の肺内病変まで検出可能であり,その同定率(95.5%)は経皮的マーキングの同定率(100%)と遜色ないと報告されている5).
近年,経静脈的ICG投与後の微小肺腫瘤(1cm未満)に対する蛍光の有無と組織診断(良悪性)の関係が報告された.悪性肺腫瘍の診断における感度は88.7%,陽性適中度は92.6%であった6).興味深いことに,同定された76結節(36症例)のうち9結節は主病変の存在する肺葉とは別の肺葉に新たに認められたものであった6).胸腔鏡下手術では触診困難なことが多く,偶発的に他病変を発見する機会が失われることが危惧されるが,本法は簡便でありかつ胸腔鏡下手術の欠点を補い得る方法として期待される.ただし,ICGは非特異的蛍光色素で,Enhanced permeability and retention(EPR)効果によって腫瘍へ蓄積するため7),過形成や炎症では偽陽性となるため注意を要す6).
病変の同定にはハイブリッド手術室でのCT-like imageも有用だが,常時使用できるとは限らず,被曝の問題もある.それぞれの手法のメリットや限界を熟知した上で選択することが肝要であろう.
III.区域切除
早期肺癌や高齢者肺癌の相対的増加や,転移性肺腫瘍に対する化学療法後の手術適応症例の増加に伴い,積極的あるいは消極的縮小手術が求められる機会が増加した.部分切除ではマージン確保が不十分な場合に区域切除が選択されることがある.区域間の同定には様々な方法が存在する.最も一般的な方法では,標的区域を選択的にジェット換気して,含気-虚脱ラインを描出するものである8).本法が成立するためには区域間の気道の交通が少ないことが前提となるため,気腔の破壊により区域間の交通のある気腫肺では本法は適さない.また,胸腔鏡下手術では,換気された肺が視野を妨げることがある.ICG蛍光法はこれらの欠点を補う方法である.
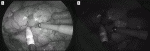
術前画像で切離すべき肺動静脈を評価した上で,術中に肺動静脈を切離後に経静脈的にICGを投与することで,解剖学的な区域間に近似した境界線が明瞭な蛍光-非蛍光ラインで描出される(図1)9).術側肺への送気を要さないため,視野の妨げにならず,気管支鏡を行う手間も必要ない.蛍光法による区域間のコントラストは時間経過とともに曖昧になり切除区域側に移動する.Munらは有効なコントラスト描出時間は70秒(30~116秒)としており,手際よく区域間のマーキングを置く必要がある10).さらに,0.25mg/kgと低用量のICGでも良好に区域間が描出できるため,複雑な区域切除を行う際に2回に分けてICGを投与して二つの区域間を別々に描出できたことも報告している.
ICG蛍光の影響因子として,気管支動脈を指摘する報告もある10).実際に,過剰のICGを投与することで気管支動脈を介した血液の流入により,区域間の描出が不良となる弊害を経験した.ICGで描出された区域間を過信することなく,不安のある時は含気法の併用も考慮すべきである.
ICGを用いた区域切除の成否を分けるのは正しい解剖を認識して切離すべき動静脈を同定できるか否かである.当科ではSYNAPSE VINCENT(富士フイルム株式会社)を用い,術前に3Dの区域切除モデルを作成して区域面と腫瘍の最短距離を計測したり,複雑な血管走行のイメージを他者と共有したりする.周到な準備にもかかわらず正しい区域間が描出できず,術中軌道修正しなければならないこともある.従ってICGで描出された区域間を過信することなく,不安のある時は含気法の併用も考慮すべきである.
IV.リンパ節マッピング
従来,肺のリンパ流は気管支に沿ったものが主流とされ,肺癌のリンパ節マッピングや予後解析はそれに基づいてきた11)12).しかし,SLNに関する数々の報告はあるが,肺におけるSLN生検は未だ確立していない.肺が厚みのある3D構造であること,肺門・縦隔リンパ節へのリンパ流路が定まっていないことなど解剖学的な問題が挙げられる.色素法13)は容易だが,炭粉沈着したリンパ節との鑑別が困難で,ごく表層の所見しか得られず,同定率は47%に留まる.RI法14)は同定率82.8%,偽陰性5.4%だが,腫瘍(トレーサーの投与部位)が肺門に近い場合やトレーサーが経気道内散布された場合にアーチファクトとなってしまう欠点がある.また,放射性同位元素の取り扱いの制限に注意を要する.
近年,ICG蛍光法によるSLNの同定が,様々な臓器で活用されている.ICGは,蛍光作用で深部まで描出可能なうえ効果発現が早く,術中リアルタイムに所見を確認できることから,リンパ流だけでなく血流評価など広く用いられている.
従来法と同様,腫瘍周囲の肺表面に注入するICG蛍光法の用量漸増試験の報告15)によると,SLN同定率80%以上を得るためにはICGを1mgから2.5mg投与する必要があることが示された.SLNが同定された15症例中の7症例にリンパ節転移を認めたが偽陰性例はなかったとしている.また27%の症例で肺門を介さずに直接縦隔リンパ節へ流入するスキップパターンを呈し,この頻度は過去の臨床研究の結果と合致していた16).ただし,肺穿刺によるICGの投与は,腫瘍の局在が同定できる場合に限られる.また,穿刺部から胸腔内へのICGの漏出はリンパ流の評価を困難にする.これらの解決策として経気管支経路にICG蛍光法を試みた報告17)がある.同定率は80%だが,偽陰性例はなかった.最近,これらの長期予後が報告18)され,pN0症例(30例)のうちSLN同定群(16例)とコントロール群(15例)で,5年生存率100% vs 70%(P=0.062),5年無病生存期間100% vs 66.1%(P=0.036)という成績だった.pN0のSLN同定群に偽陰性はなく,SLN陰性は真のpN0であることが示唆されており,今後は大規模な臨床試験での検証が期待される.
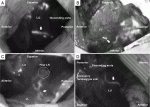
当科では,スキップパターンを呈す原因として,胸膜(臓側胸膜,縦隔胸膜)に沿ったリンパ流の存在を考えている.自験例19)では,ICG蛍光法で58%の症例で胸膜に沿ったリンパ路を描出し得た.描出されたリンパ路のうちの38%は肺葉外(主として隣接肺葉)に向かっていた.全症例中の11%にスキップパターンを認め,その中には腫瘍から胸膜リンパ路を介した縦隔リンパ節への流入が示唆される症例を認めた(図2).現在,リンパ節転移における胸膜リンパ路の関与についてさらなる検討を行っている.肺癌のリンパドレナージ経路は多様性に富んでおり,それゆえに個々のドレナージ経路に基づいたリンパ節郭清を行うことは臨床的に意義深いと思われる.
V.乳糜胸
乳糜の漏出点の同定法として,鼠径リンパ節に穿刺注入するICG蛍光法の報告が散見されるようになった20).現在,筆者の経験も投稿中である.手技は簡便で,術中リアルタイムに漏出部を同定でき,蛍光は2時間程持続したため修復後の確認にも有用であった.
VI.おわりに
小型早期肺癌や高齢者肺癌手術の増加に伴い,縮小手術や選択的リンパ節郭清ならびに低侵襲アプローチの適応は拡大傾向である.触知困難な小型病変の同定や区域切除におけるICG蛍光法は有用で,既に日常診療で活用されている.肺のSLN生検は未だ確立されていないが,ICG法がその解決の糸口となることが期待される.
利益相反:なし
文献
1) Committee for Scientific Affairs, TJAfTS., Shimizu H, Endo S, et al.: Thoracic and cardiovascular surgery in Japan in 2016:annual report by The Japanese Association for Thoracic Surgery. Gen Thorac Cardiovasc Surg, 67: 377-411, 2019.
2) Ichinose J, Kohno T, Fujimori S, et al.: Efficacy and complications of computed tomography-guided hook wire localization. Ann Thorac Surg, 96: 1203-1208, 2013.
3) Otsuka T, Nakamura Y, Harada A, et al.: Extremely rare but potential complication of diffuse brain edema due to air embolism during lung segmentectomy with selected segmental inflation technique by syringe needle during video-assisted thoracoscopic surgery. J Thorac Cardiovasc Surg, 142:e151-152, 2011.
4) Anayama T, Qiu J, Chan H, et al.: Localization of pulmonary nodules using navigation bronchoscope and a near-infrared fluorescence thoracoscope. Ann Thorac Surg, 99: 224-230, 2015.
5) Anayama T, Hirohashi K, Miyazaki R, et al.: Near-infrared dye marking for thoracoscopic resection of small-sized pulmonary nodules:Comparison of percutaneous and bronchoscopic injection techniques. J Cardiothorac Surg, 13: 5, 2018.
6) Mao Y, Chi C, Yang F, et al.: The identification of sub-centimetre nodules by near-infrared fluorescence thoracoscopic systems in pulmonary resection surgeries. Eur J Cardiothorac Surg, 52: 1190-1196, 2017.
7) Jiang JX, Keating JJ, Jesus EMD, et al.: Optimization of the enhanced permeability and retention effect for near-infrared imaging of solid tumors with indocyanine green. Am J Nucl Med Mol Imaging, 5: 390-400, 2015.
8) Okada M, Mimura T, Ikegaki J, et al.: A novel video-assisted anatomic segmentectomy technique: selective segmental inflation via bronchofiberoptic jet followed by cautery cutting. J Thorac Cardiovasc Surg, 233: 753-758, 2007.
9) Misaki N, Chang SS, Igai H, et al.: New clinically applicable method for visualizing adjacent lung segments using an infrared thoracoscopy system. J Thorac Cardiovasc Surg, 140: 752-756, 2010.
10) Mun M, Okumura S, Nakao M, et al.: Indocyanine green fluorescence-navigated thoracoscopic anatomical segmentectomy. J Vis Surg, 7: 80, 2017.
11) Naruke T, Suemasu K, Ishikawa S: Lymph node mapping and curability at various levels of metastasis in resected lung cancer. J Thorac Cardiovasc Surg, 76: 832-839, 1978.
12) Mountain CF: Revisions in the international system for staging lung cancer. Chest, 111: 1710-1717, 1997.
13) Little AG, DeHoyos A, Kirgan DM, et al.: Intraoperative lymphatic mapping for non-small cell lung cancer: The sentinel node technique. J Thorac Cardiovasc Surg, 117: 220-224, 1999.
14) Liptay MJ, Masters GA, Winchester DJ, et al.: Intraoperative radioisotope sentinel lymph node mapping in non-small cell lung cancer. Ann Thrac Surg, 70: 384-389, 2000.
15) Gilmore DM, Khullar OV, Jaklitsch MT, et al.: Identification of Metastatic Nodal Disease in a Phase I Dose Escalation Trial of Intraoperative Sentinel Lymph Node Mapping in NSCLC using Near-Infrared Imaging. J Thorac Cardiovasc Surg, 146: 562-570, 2013.
16) Liptay M: Sentinel Node Mapping in Lung Cancer. Ann Surg Oncol, 11: 271S-274S, 2014.
17) Hachey KJ, Digesu CS, Armstrong KW, et al.: A Novel Technique for Tumor Localization and Targeted Lymphatic Mapping in Early Stage Lung Cancer. J Thorac Cardiovasc Surg, 154: 1110-1118, 2017.
18) Digesu CS, Hachey KJ, Gilmore DM, et al.: Long-term outcomes after near-infrared sentinel lymph node mapping in non-small cell lung cancer. J Thorac Cardiovasc Surg, 155: 1280-1291, 2018.
19) Takeda AH, Watanabe Y, Nagata T, et al.: Detection of alternative subpleural lymph flow pathways using indocyanine green fluorescence. Surg Today, 48: 640-648, 2018.
20) Yang F, Zhou J, Yang F, et al.: Near-infrared fluorescence-guided thoracoscopic surgical interventionan for postoperative chylothorax. Interact Cardiovasc Thorac Surg, 26: 171-175, 2018.
PDFを閲覧するためには Adobe Reader が必要です。