日外会誌. 121(1): 39-47, 2020
特集
蛍光ガイド手術の現状と展望
6.心臓血管外科領域における研究と展望
|
高知大学医学部 外科学外科二 渡橋 和政 |
心臓血管外科領域においては,indocyanine green(ICG)蛍光造影は脈管の血流評価や組織の灌流評価で用いられる.放射線被曝もなく繰り返し術野で評価ができるメリットがあるが,蛍光の組織透過性が乏しい(特に皮膚や脂肪織)という弱点がある.冠動脈バイパス術では,グラフトの開存や狭窄を術中に評価できるため,グラフトの開存率向上に役立つ.transit-time flowmetryによる評価と乖離がみられることがあるが,報告ではICG造影による評価の方がより信頼されている.しかし,定量的評価は十分確立しておらず,輝度曲線の解析も自動化が待たれる.閉塞性動脈硬化症など末梢動脈病変に対しては,血行再建術のグラフト評価に用いられることが多いが,皮下トンネル内のグラフトは見えないため吻合部付近で評価する.また,下肢虚血を体表から評価する方法も行われており,潰瘍を伴う病変ではdebridementの範囲を決定したり血行再建の評価に用いられている.ABIのように動脈硬化の影響を受けずに灌流を評価できるメリットがある.リンパ系では,主にリンパ浮腫を対象に,リンパ浮腫の鑑別診断,リンパドレナージの効果判定,リンパ管静脈吻合の場所の決定や吻合の評価などに用いられている.メリットを活かす一方で弱点を理解しそれを補う方策を準備しておくことで,治療成績の向上に寄与できるだろう.
キーワード
indocyanine green, 蛍光, 冠動脈バイパス術, 末梢動脈疾患, リンパ浮腫
I.はじめに
心臓血管外科領域では,大きく二つの目的にindocyanine green(ICG)蛍光造影を用いる.一つは,脈管(動脈,静脈,リンパ管)やグラフト内を流れる血液やリンパ液を可視化することにより,血流の有無や勢いあるいは管腔の大きさや分布を評価することで,従来の血管造影やリンパ管造影にあたる.専用のカメラと装置があればICGを静脈投与するだけで造影でき,放射線画像診断のように腎に負担をかける造影剤も用いず放射線被曝もなく繰返し評価できるため,術中のさまざまな評価に用いられる.もう一つは,組織灌流の評価である.組織全体の輝度が上昇する速度やその分布(マッピング)を評価することにより,組織全体の灌流状況に加え局所的な灌流障害の部位や範囲を特定することができる.放射線診断でもCTを用いれば同様な情報は得られるが,被曝が造影透視よりも多く,術中に行うにはハイブリッド手術室のような特殊な環境でcone beam CTを用いる必要があり,手術操作のrevisionが必要か否かの判断はともかく,revisionしてまた評価という目的には適していない.ICG造影は,以上の二つの評価を通じて,正常な管腔,臓器の解剖・生理学的な情報が得られることに加え,病態の把握,疾患に対して行うさまざまな治療の評価にも用いられる.他領域と異なりこの領域では短時間で画像が変化する対象が多いため,動画も提供している論文が多い.以下,これまで報告された応用法についてまとめ,現在の課題や将来への展望についても少し触れたい.またICG造影に関する論文は,本邦から発信したものが多いことがわかるだろう.
II.冠動脈バイパス術
冠動脈の狭窄・閉塞が引き起こす心筋の灌流障害(虚血性心疾患)に対して,内胸動脈グラフトや大伏在静脈グラフトを用いて冠動脈バイパス術(coronary artery bypass grafting:CABG)が行われる.虚血性心疾患の病態を把握したりCABGの結果を評価する目的でICG造影が用いられたのは,2002年Detterらがブタを用いて左前下行枝やその灌流領域の心筋灌流を造影したことに始まる1).彼らは,①冠動脈閉塞により,冠動脈も灌流領域の心筋も造影されなくなる,②虚血領域の冠動脈に血行再建を行うと,グラフトも灌流領域も再び造影されるようになる,③そのグラフトを閉塞すると,グラフトも灌流領域も造影されなくなることを報告し,現在ICG造影を用いるほぼすべての評価を網羅した.
翌年,Taggartらは臨床でCABGの84症例(off-pump,on-pumpを含む213グラフト)におけるICG造影の結果を報告した2).彼らは,pedicleで採取したグラフトよりskeletonizeで採取したグラフトの方がより明瞭に造影されることを見いだし,他領域ではあまり経験しない「脂肪組織被覆による造影不良」という組織透過性の低さによるICG造影の弱点を指摘した.また,213本のうち造影されなかった4本のグラフトに対して再吻合を行い,ICG造影を用いると手術室を出る前に術後冠動脈造影(coronary arteriography:CAG)と同等の評価が可能であることを示した.そして,ICG造影で定量的評価ができればさらに有用性が高まるだろう,と述べている.
CABGにおける術中グラフト評価としては,transit-time flowmetry (TTF)がすでに用いられており,いずれがより正確で有用かという検討がなされた.Balacumaraswamiらは,100症例266グラフトでICG造影評価とTTF評価を比較し,100例中8例は両者とも血流が不良と評価され再吻合を行ったが,他の10例ではTTFで平均流量やpulsatility indexから血流不良と評価されたもののICG造影では十分な血流ありと評価され,評価に乖離があることを報告した3).Wasedaらは,137症例507グラフトでICG造影,TTF評価,術後CAG所見を詳細に比較し,6本のグラフトはTTFでacceptableだったが,ICG造影でgraft failureと評価されたため再吻合を行い,術後CAGではいずれも開存が確認された4).また,TTFで不十分と評価された他の21本のグラフトは,ICG造影でacceptableと判断されたため,再吻合しなかったところ,21本中20本は術後CAGで開存していた.彼らは,ICG造影は形態情報に加えて機能情報も得られ,off-pumpバイパス症例で早期グラフト不全を減らすのに役立つと述べた.Kuroyanagiらも,off-pump CABGの159症例435グラフトにおける検討結果を報告し,ICG造影とTTF評価の併用によりグラフトの開存率が高まると報告している5).
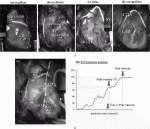
ここまでは主にSPYシステムが用いられ,gray scaleの画像で輝度を用いた評価がなされていたが,Handaらは,術野のカラー画像に蛍光画像をsuperimposeして表示できるHEMS(HyperEye Medical System)を用いてグラフト評価を行い,吻合部から逆行性に起こった内胸動脈グラフトの解離も可視化できることを報告した6)(図1A).ロボット支援下のminimally invasive direct CABGも行われるようになり,Nakamuraらはda Vinci surgical systemで左内胸動脈(LITA)を採取した30症例でロボット支援下手術用のFireflyを用いて,LITA切離前と吻合後に血流の評価を行っている7).
CAGでは狭窄度の定量的評価にdensitometryが用いられるが,ICG造影では輝度変化を計測する.Yamamotoらは,in vitroで狭窄の程度による輝度変化について基礎的検討を行い,最大輝度に達するまでの時間,最大輝度の1/√2に達するまでの時間を計測して,狭窄度が高いほど輝度上昇の速度が低下することを報告した8)(図1B).現在は,得られたICG造影画像からオフラインで解析を行っているが,今後はICG造影装置にROIを定めて自動的に輝度が測定できるシステムが開発されるだろう.ただ,心臓は拍動で動くため,ROIがターゲットを正確に追随できる機能も必要になるだろう.
ただ,ICG造影では,心表面に厚い脂肪織があるとnativeの冠動脈が見えにくく,心筋の輝度上昇も脂肪織がない範囲しか正確な評価ができない.これはICG造影の原理に関わる限界であるため,現実的な解決策として他のmodalityをうまく組み合わせることが望ましい.著者は,ICG造影とTTFで評価の乖離が見られた場合,12~15MHzのリニア型術野エコープローブを用いて,グラフト血流をカラードプラやパルスドプラで評価し,吻合部ではカラードプラで長軸・短軸の断面を描出して吻合部の径を測定している.口径が2方向で十分なら吻合部の問題でないことは明らかで,再吻合しても吻合の質は改善せず,デメリットの方が大きい.そのような場合,しばしば冠動脈末梢のrun-offが原因である.
III.末梢動脈病変
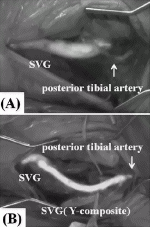
閉塞性動脈硬化症など末梢動脈病変に対するICG造影の応用は,2008年にUnnoらが血行再建手術の術中評価に用いたことに始まる9).彼らはparamaleolar artery bypassの9症例でICG造影を行い,グラフトが造影されなかった1例でドプラ血流計を用いて確認したところ,遠位側吻合部の血栓閉塞が確認された.ICG造影を行えない場合,患者をカテ室に搬送するか,解像度の低い移動式の透視装置を用いて動脈造影をする必要があるが,ICG造影はそれに代わりうる評価法となった.ただ,グラフトの経路に沿って大きく開創する手術ではグラフト全体が造影できるが,reversed法でも皮下トンネルを作成してグラフトを通したり,in situ法では蛍光が皮膚や皮下組織を十分透過しないため可視化できない.Yamamotoらは,大伏在静脈グラフトを用いて後脛骨動脈に血行再建を行った症例で,末梢側吻合部のICG造影を行った10)(図2).吻合部より中枢側の後脛骨動脈は造影されたが末梢側が造影されなかったため,大伏在静脈グラフトから後脛骨動脈末梢へのY-compositeグラフトを追加して末梢まで造影されるようになったと報告している.これは,CABGにおけるグラフト評価と同様,グラフトから末梢動脈にかけてスムーズに輝度が上昇するか否かという定性的な評価法である.ICG造影で明確に判断できない場合,術野エコーを用いてグラフト血流を計測したり吻合部を描出して評価など代替評価法を持っておけば,ICG造影の限界を補うことが可能となる.また,さらに末梢の動脈でドプラ血流計を用いて血流を計測しながら,グラフトを一時遮断することにより血流が激減することでもある程度評価できる.
下肢の灌流を皮膚の輝度上昇として評価する報告も見られる.Kangらは,跛行で来院し,左下肢のABIが低下していた症例でICG造影を行った11).CT angiographyで左外腸骨動脈以下に複数箇所狭窄,閉塞を認め,ICG造影で足の輝度がピークに達するまでの時間が遅延しwashoutも遅延していた.ただ,この症例における評価は健側肢を対照とする相対的評価であり,両側に虚血がある場合(Leriche症候群など)には上肢など別の対照を用いる必要がある.Zimmermannらは,下肢切断を行った10症例でICG造影を行い,6例では断端の灌流欠損は認めず術後の創治癒も良好であったが,3例で断端の皮膚に灌流欠損を認め,その後に再手術となったと報告している12).同様に,Perryらは潰瘍を伴う下肢虚血に対しtibial bypassを行った症例でICG造影を行い,debridementを行うべき範囲をICG造影で明確に知ることができたと報告している13).灌流低下を皮膚の色調で評価するのは必ずしも容易でなく,全般的あるいは局所的な灌流低下を明確に評価するためにICG造影は有用である.
Igariらは,血行再建前後の変化をICG造影による輝度変化(最大輝度の1/2レベルに達する時間)で評価した14).輝度やその変化は部位によって異なるが,第一中足骨付近にROIを置くと最も正確に評価ができることを見いだした.Settembreらは,血行再建(手術,血管内治療を含む)95症例でtime-intensity curveを用いて治療の評価を行い,ABIはpseudohypertensionのため不確実となることがあり,toe pressureはminor amputationのため不確実であるのに対し,ICG造影は全例で適切な評価が可能であったと報告した15).Rotherらは,Rutherford stage Ⅳ to Ⅵの下肢虚血に対してtibial bypassを行った40症例で前向きに術前・術後の評価を比較検討し,全体的な血行(macrocirculation)をABIで評価し,微小循環(microcirculation)はangiosomeごとにICGで評価した16).バイパス後,全体的な血行は改善し,各angiosomeで改善が見られた.吻合可能な血管が当該領域になく,別のangiosomeの部位に血行再建されても,改善に差はなく創治癒も同様であった.
ただ,皮膚の輝度上昇は必ずしも明瞭ではない.皮膚の血流が少なく,皮膚が厚い症例や色素沈着がある症例では皮下組織の血流由来の蛍光が減衰してしまうことが予想される.むしろこの領域には,今後光超音波などの別のmodalityを併用することが必要となるかもしれない.
IV.リンパ系
ICG造影は,形成外科,血管外科で主にリンパ浮腫を対象として行われてきた.2007年にUnnoらは二次性リンパ浮腫12例と健常者10名でICGリンパ管造影所見を比較検討し,前者で見られる所見として,①dermal backflow,②extended fluorescent signal at the dorsum and plantar region of the foot,③dilated lymph channels with proximal obliteration,④diffuse glittering of fluorescent signals with scattered twinkling of the dyeの四つを報告した17).Narushimaらは,リンパ浮腫の進行に伴うICG造影所見の変化を評価し,normal linear patternからabnormal dermal backflow patternになり,後者はsplash patternからstardust pattern,ついにはdiffuse patternになると報告した18).
リンパ管静脈吻合においてもICG造影が用いられている.Yamamotoらは,134症例で術前にICGリンパ管造影を行い,術中に測定したリンパ管径と比較した19).ICG造影ではlinear, splash, stardust, diffuseなどの所見がみられるが,diffuse patternの領域では吻合に適した0.5mm以上のリンパ管を見つけにくいためこの領域は避けるべきと報告し,ICG造影が手術のナビゲーションとして有用であることを示した.一方,Ogataらはリンパ管静脈吻合にICG造影を用い,吻合の評価に役立つことを報告している20).
これら以外にも,リンパ系に関してリンパ流路の解明をはじめ,リンパ管のポンプ機能評価,リンパ浮腫の鑑別診断など多くの研究がなされている(表1).リンパ浮腫に対してリンパ管静脈吻合を行う場合でも,術後継続して圧迫療法や用手リンパドレナージを行う必要があるが,ドレナージの手法を習得する上でも,ICG造影をしながらリンパ液の貯留,ドレナージによる移動を見ながら練習することにより,習得の効率が高まると思われる.
V.その他の応用
ICG造影のその他の応用法を表2に示す.開心術における心筋保護では,大動脈や冠静脈洞から注入した心筋保護液がどのように心筋に分布するのかを知る手立てはない.ICG造影を用いると,心筋に心筋保護液が分布する様子を可視化することができ,逆行性心筋保護では必ずしもすみずみまで心筋保護液が行き渡らないことも明らかとなった.
小児心臓手術では,姑息手術や再建手術において,吻合部狭窄やconduitの通過障害などがないかを術中に評価することがICG造影で可能になる.従来,術中に外科医が術野エコーで観察したり麻酔科医が経食道心エコー法で評価していたが,これに形態的,血行動態的な情報が加わってより詳細な評価が可能になり,術後評価の結果再手術が必要となる症例が少しでも減ることが期待される.
また,冠動脈瘻や上肢の動静脈奇形の手術でも,放射線を用いる造影透視ではなく,ICG造影で評価する方法も報告されている.より詳細なナビゲーションが可能となり,状況に応じて選択枝が増えることとなり,これも治療成績の向上に役立つ可能性がある.
今回のテーマとは少し外れるが,心臓血管外科領域では近赤外線をICG造影に用いるばかりでなく,組織内の酸素飽和度を測定する「近赤外線分光法」が1990年代から広く用いられている.これは,ICG造影で評価できる血管内の血流情報,組織の輝度上昇における組織灌流の評価に加え,組織内の酸素需給バランスを直接数字データとして非侵襲的かつリアルタイムに得ることができるmodalityである.この形態情報と酸素飽和度の情報が,光超音波法で融合されることとなる.

VI.おわりに
ICG造影は,造影透視法に類似した画像情報を放射線被曝なく術中に提供してくれる方法であり,そのメリットを最大限に用いるとともに,限界もしっかりと把握し,それを補うための手段として,近赤外線分光法,超音波断層法,ドプラ法による血流評価(TTFやカラードプラ法を含む)を適宜併用することで,手術の効率,安全性を高め,治療成績をさらに向上させることに寄与すると考える.今後,さらに高齢化,複数の既往歴や併存疾患などいくつものハンディがあるなかで従来以上の適応範囲の患者に対し,従来以上の治療成績を達成するためには,これらの知識とともに適宜それを用いることができる準備をしておくことが望ましい.本稿が,そのための一助となれば幸いである.
利益相反:なし
文献
1) Detter C, Russ D, Iffland A, et al.: Near-infrared fluorescence coronary angiography:a new noninvasive technology for intraoperative graft patency control. Heart Surg Forum, 5: 364-369, 2002.
2) Taggart DP, Choudhary B, Anastasiadis K, et al.: Preliminary experience with a novel intraoperative fluorescence imaging technique to evaluate the patency of bypass grafts in total arterial revascularization. Ann Thorac Surg, 75: 870-873, 2003.
3) Balacumaraswami L, Abu-Omar Y, Choudhary B, et al.: A comparison of transit-time flowmetry and intraoperative fluorescence imaging for assessing coronary artery bypass graft patency. J Thorac Cardiovasc Surg, 130: 315-320, 2005.
4) Waseda K, Ako J, Hasegawa T, et al.: Intraoperative fluorescence imaging system for on-site assessment of off-pump coronary artery bypass graft. JACC Cardiovasc Imaging, 2: 604-612, 2009.
5) Kuroyanagi S, Asai T, Suzuki T: Intraoperative fluorescence imaging after transit-time flow measurement during coronary artery bypass grafting. Innovations (Phila), 7: 435-440, 2012.
6) Handa T, Katare RG, Sasaguri S, et al.: Preliminary experience for the evaluation of the intraoperative graft patency with real color charge-coupled device camera system:an advanced device for simultaneous capturing of color and near-infrared images during coronary artery bypass graft. Interact Cardiovasc Thorac Surg, 9: 150-154, 2009.
7) Nakamura Y, Kuroda M, Ito Y, et al.: Left internal thoracic artery graft assessment by Firefly fluorescence imaging for robot-assisted minimally invasive direct coronary artery bypass. Innovations (Phila), 14: 144-150, 2019.
8) Yamamoto M, Nishimori H, Fukutomi T, et al.: Influence of vessel stenosis on indocyanine green fluorescence intensity assessed by near-infrared fluorescence angiography. Surg Today, 47: 877-882, 2017.
9) Unno N, Suzuki M, Yamamoto N, et al.: Indocyanine green fluorescence angiography for intraoperative assessment of blood flow:a feasibility study. Eur J Vasc Endovasc Surg, 35: 205-207, 2008.
10) Yamamoto M, Sasaguri S, Sato T: Assessing intraoperative blood flow in cardiovascular surgery. Surg Today, 41: 1467-1474, 2011.
11) Kang Y, Lee J, Kwon K, et al.: Application of novel dynamic optical imaging for evaluation of peripheral tissue perfusion. Int J Cardiol, 145:e99-101, 2010.
12) Zimmermann A, Roenneberg C, Wendorff H, et al.: Early postoperative detection of tissue necrosis in amputation stumps with indocyanine green fluorescence angiography. Vasc Endovascular Surg, 44: 269-273, 2010.
13) Perry D, Bharara M, Armstrong DG, et al.: Intraoperative fluorescence vascular angiography:during tibial bypass. J Diabetes Sci Technol, 6: 204-208, 2012.
14) Igari K, Kudo T, Toyofuku T, et al.: Quantitative evaluation of the outcomes of revascularization procedures for peripheral arterial disease using indocyanine green angiography. Eur J Vasc Endovasc Surg, 46: 460-465, 2013.
15) Settembre N, Kauhanen P, Albäck A, et al.: Quality control of the foot revascularization using indocyanine green fluorescence imaging. World J Surg, 41: 1919-1926, 2017.
16) Rother U, Lang W, Horch RE, et al.: Pilot assessment of the angiosome concept by intra-operative fluorescence angiography after tibial bypass surgery. Eur J Vasc Endovasc Surg, 55: 215-221, 2018.
17) Unno N, Inuzuka K, Suzuki M, et al.: Preliminary experience with a novel fluorescence lymphography using indocyanine green in patients with secondary lymphedema. J Vasc Surg, 45: 1016-1021, 2007.
18) Narushima M, Yamamoto T, Ogata F, et al.: Indocyanine green lymphography findings in limb lymphedema. J Reconstr Microsurg, 32: 72-79, 2016.
19) Yamamoto T, Narushima M, Koshima I: Lymphatic vessel diameter in female pelvic cancer-related lower extremity lymphedematous limbs. J Surg Oncol, 117: 1157-1163, 2018.
20) Ogata F, Narushima M, Mihara M, et al.: Intraoperative lymphography using indocyanine green dye for near-infrared fluorescence labeling in lymphedema. Ann Plast Surg, 59: 180-184, 2007.
PDFを閲覧するためには Adobe Reader が必要です。