日外会誌. 121(1): 27-33, 2020
特集
蛍光ガイド手術の現状と展望
4.MIPSが拓く新たな時代
|
1) 京都大学 肝胆膵・移植外科 瀬尾 智1) , 波多野 悦朗2) , 西野 裕人1) , 新田 隆士3) , 上本 伸二1) |
肝切除術において術前シミュレーションは必須となったが,術中の肝臓の動きや変形には追従できず術中ナビゲーションの開発が期待される.肝切除においてICG蛍光法は肝区域可視化や肝腫瘍同定に有用でリアルタイムの情報を提供しうるが,ハンドヘルドカメラを用いる従来法の継続的な使用は非現実的である.われわれはこれまでエンターテインメントで多く用いられてきたプロジェクションマッピングの技術を応用し,ICG蛍光画像を直接患者の臓器に投影するシステムMedical Imaging Projection System(MIPS)を産学連携プロジェクトとして共同開発し,改良を重ねてきた.MIPSを用いることで術中リアルタイムナビゲーションが可能となったが,これまでの使用経験からICG蛍光法の克服すべき課題も抽出されてきた.今後MIPSが肝切除で普及し他領域手術へ適応拡大されることで,ICG蛍光法および術中ナビゲーションが新たな時代を迎えることを期待する.
キーワード
ナビゲーション手術, プロジェクションマッピング, ICG蛍光法, 肝切除
I.はじめに
肝切除は系統的切除と非系統的(部分)切除に大別されるが,何れの術式でも術前画像の3D再構築像を用いたシミュレーションは必須となっている.これにより安全かつ精緻な肝切除を施行するための術中ナビゲーションが必要となったが,1980年代からその役割は術中超音波のみが果たしてきた.系統的切除ではメルクマールとなる主肝静脈を,部分切除では腫瘍を描出することで切除完了までをナビゲーションするが,確認作業の際は切離を中断する必要があり,継続的な使用は出来ない.すなわち間欠的なナビゲーションである.
II.系統的肝切除の問題点
安全で精緻な系統的切除を行うために,大きく二つの方法が用いられてきた.一つはMakuuchiらにより報告された担癌領域の門脈枝を穿刺しインジゴカルミン等の色素を注入することで肝表面の区域境界いわゆるdemarcation lineを描出する方法である1).もう一つはTakasakiによって報告された担癌領域に流入するグリソン鞘の血流を遮断してdemarcation lineを描出する方法である2).これらの方法で同定したdemarcation lineをもとに肝切離を開始し,区域境界線上に存在するとされる主肝静脈を広範囲に露出することが理想的な切離ラインとされてきた.両者に共通する問題点は,始点と終点のみが可視化されておりメルクマールとなる主肝静脈への到達はナビゲーション出来ないことである.加えて硬変肝や高度癒着のある再肝切除症例ではdemarcation lineが視認できないことをしばしば経験し,安全で精緻な系統的切除を行うのは容易ではない.
III.肝部分切除の問題点
肝部分切除では腫瘍の位置を正確に同定しなければ切離線を決定出来ないが,大腸癌化学療法の進歩に伴い縮小した腫瘍の同定が困難となる症例の報告が増加している3).当科ではソナゾイド造影を含む術中超音波検査で腫瘍の同定を行っているが,同定困難な症例もしばしば経験される.
IV.術前シミュレーションから術中ナビゲーションへ
SYNAPSE VINCENT(富士フイルム株式会社製)などのソフトウェアを用いて術前CT画像から肝臓・脈管・腫瘍の位置を三次元再構築し,根治性と耐術性のバランスを考慮しながら切離ラインを決定する術前シミュレーションは,2012年の保険点数加算を経て多くの施設で施行され必須となっている.しかしながら,シミュレーション画像は術中の位置移動や臓器変形には対応できないため,リアルタイムの情報を反映することはできない.術前シミュレーション画像の技術革新が詳細な手術術式立案を可能にしたが,シミュレーション通りに手術を施行するためには術中の位置移動・変形に追従する術中ナビゲーションの確立が必要となった.具体的には,リアルタイムな情報に基づいた継続的なナビゲーションを可能とするシステムの開発である.
V.ICG蛍光法を用いた術中ナビゲーションとその問題点
近年蛍光色素を用いた術中ナビゲーションの開発が進歩してきており,特にインドシアニングリーン(ICG)と近赤外カメラシステムを用いたICG蛍光法が注目されている.この技術は血漿蛋白と結合したICGに励起光を当てることでより長波長の蛍光発光をきたし,その波長がいずれもヘモグロビンと水の吸収波長の範囲内にあるというメカニズム4)を用いている.肝臓外科領域では肝区域の可視化5),肝腫瘍の同定6),胆管の描出7)などで有用であることが報告されてきた.
ICG蛍光法による肝区域の可視化は2008年にAokiらによって報告5)されて以降,系統的切除に用いられてきた.ICGは肝細胞の膜に発現するOATPとNTCPを介して肝細胞内に取り込まれ,MDR3を通して細胆管に排泄されるまで肝細胞内に蓄積し,胆汁から排泄される8).肝細胞に蓄積したICGが数時間停滞することを用いて,術中に経静脈的あるいは経門脈的に投与すれば肝区域の可視化が可能となる.ICGは多くの分野で有用性が報告されているが,このメカニズムの応用は肝臓に特異的で肝区域を可視化にきわめて有用である.実際に本手法を系統的切除の肝実質切離面の確認に応用した報告もある9).
一方,ICG蛍光法による腫瘍の同定は2009年にIshizawaらによって報告されて以降,多く用いられてきた.肝細胞癌の高~中分化型で腫瘍内部にICG蛍光が,肝細胞癌の低分化型や転移性肝癌では周囲の非癌部肝実質にリング状にICG蛍光が観察される6).正常肝においては数時間から数日程度でICGが肝細胞から胆管に排泄されるが,肝細胞癌においては排泄系のMRP2などが障害されていることで胆汁排泄が遅延することから,投与後数週間にわたりICGの蓄積が持続する10).一方,低分化型の肝細胞癌や転移性肝癌においてはICGが腫瘍組織に取り込まれないが,腫瘍周囲の胆管が圧排されることで胆汁排泄障害が起こり腫瘍周囲にICGが蓄積する.また近年では肝細胞癌の高~中分化型においても腫瘍内部のみならず腫瘍周囲にICGの集積が認められると報告されている11).
しかしながら,従来のハンドヘルド型カメラを用いたシステムにはいくつか問題点がある.モニタに写った蛍光画像を見るために術野とモニタの間で頻回の視線移動が必要になるという点,カメラを保持する人手が必要であると同時に持ち手の動きにより画像の揺れが生じる点,無影灯に含まれる白色光の干渉を取り除くために,観察時は無影灯を消す必要があるという点などである.これらの問題点から術中にICG蛍光画像を継続的に観察することは非現実的であった.
VI.プロジェクションマッピングの医療への応用
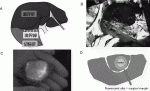
われわれはこれまでエンターテインメントで多く用いられてきたプロジェクションマッピングの技術を応用し,ICG蛍光画像を直接患者の臓器に投影するシステムMIPSを産学連携プロジェクトとして共同開発し12),改良を重ねてきた(図1A).この機器では位置ずれを1mm以下に,投影までの時間差を0.1秒未満に短縮することが実現でき,これにより肝臓の動きや変形に対してもICG蛍光画像がリアルタイムで追従することが可能となった.また蛍光発光部位を特定の色に,非蛍光部位を白色に変換するアルゴリズムを用いることで無影灯を消灯しても十分に明るい術野を提供することも可能となった(図1B,C).
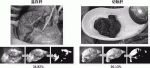
MIPSを用いることで,系統的肝切除においては切除肝と温存肝の境界線がICG蛍光発光の有無として肝実質切離中も継続的に投影される.すなわち肝切離の開始から終了まで蛍光発光の有無が示す境界線を守ることでリアルタイムナビゲーション肝切除が可能となった(図2A,B).肝部分切除においては腫瘍周囲が蛍光発光する性質を用いて,蛍光発光を露出させないことでサージカルマージンの確保が可能となり,根治性の高い肝部分切除のリアルタイムナビゲーションが可能となった(図2C,D).

VII.MIPSの使用経験
i)系統的肝切除での使用
①MIPSの間欠的使用による肝切除
当院でMIPSを用いて系統的肝切除を施行した23例のうち,91.3%で術前シミュレーションによるdemarcation lineと投影された境界線が一致した.また同時期にMIPSを用いずに系統的肝切除を行った29例と比較したところ,両群に術前患者背景,手術時間,出血量,術後合併症発症率に有意な差はなく,1年無病生存率は統計学的に有意ではないもののMIPS使用群が良好で,MIPSは正確性だけでなく根治性にも寄与する可能性が示唆された12).
ICGの投与方法は,切除予定領域に流入する門脈を超音波ガイド下に穿刺し経門脈的に投与して切除側を蛍光発光させる方法(positive staining)と,切除予定領域へ流入する血流を肝門部で遮断し経静脈的に投与して温存側を蛍光発光させる方法(negative staining)のいずれでも可能であった.
②MIPSの継続的使用による肝切除(リアルタイムナビゲーション肝切除)
当院でMIPSを用いて行ったリアルタイムナビゲーション系統的切除4例とMIPSを用いずに系統的切除を行った4例を対象に肝切離面の正確さを比較した.これまで術前シミュレーションの正確性評価には予測切除肝容積と切除肝重量の相関が用いられてきた13).しかし,肝の比重が1g/mLではないことや切離線が正しくなくても切除肝重量が予測切除肝容積と一致する可能性は否定できず,この評価法には議論の余地がある.そこでわれわれは新たな評価法として切離面のICG蛍光発光面積率を用いることを推奨している.実際の評価法であるが,肝切離終了後にpde-neo(浜松ホトニクス株式会社製)を用いて切除肝と温存肝の肝切離面のICG蛍光画像を記録し,画像解析ソフトで蛍光発光面積率をdensitometryにより測定する.得られた値から(温存肝蛍光発光面積率)-(切除肝蛍光発光面積率)=(正確な切離面積率)として評価することを考案している(図3).結果は術前肝機能などの患者背景,手術時間・肝切離時間・出血量などの手術関連因子,術後合併症の有無に関して両群に統計学的な有意差は認めなかった.正確な切離面積率はMIPSガイド群:24.2±7.0%,非MIPSガイド群:10.3±4.1%(p=0.14)で統計学的有意差は認めなかったものの,MIPSガイド群でより正確性が高い傾向を認めた.
ⅱ)肝部分切除での使用
当院で開腹肝切除を行った15例(原発7例,転移8例)に対しMIPSとpde-neoを各々用いて,術前画像で肝表から10mm以内に存在した表層腫瘍30病変の同定率を比較した.同定率はいずれも17/30(56.7%)と同等で,同定腫瘍の最大径中央値は12(1~106)mmであった.術前画像で指摘されなかった病変を計8病変同定,術中超音波検査でも指摘できた6病変を切除し2個(33.3%)で病理学的に悪性の診断であった.MIPSは従来法と同等の検出率で,視線移動や手ぶれによる画像の揺れがない利点を享受でき,術中超音波検査との併用にも有用であった.
VIII.ICG蛍光法を用いたリアルタイムナビゲーション肝切除の問題点
ⅰ)系統的肝切除での問題点
至適な投与経路と投与量の確立が問題点として挙げられる.われわれは当初投与量を2.5mg/bodyで統一していたが,経静脈投与でも流入血を個別処理した症例では肝切離中に切除肝の蛍光発光を徐々に認めた.以後0.25mg/bodyに希釈し,同様の事象を経験せず問題なく使用できている.経門脈および動脈投与ではさらに希釈することが可能であると考えられ,至適投与量の確立が急がれる.
ⅱ)肝部分切除における問題点
偽陽性・偽陰性が一定数存在することが問題点である.現在われわれは,術中超音波検査で描出出来ない病変は切除適応としていないが,切離断面に微小蛍光発光を認め,超音波検査が出来ないため切除したところ病理学的に微小転移と診断された経験もあり(図4)今後更なる検討を要すると考えられた.

IX.MIPSが拓く新たな時代―今後の展望―
2010年の保険収載以降腹腔鏡下肝切除は当科においても増加傾向にあるが,再肝切除や巨大腫瘍など開腹手術でなければ対応できない症例も数多く認める.しかし,ICG蛍光法には先に述べた問題点が山積しているため,現時点では腹腔鏡および開腹の知見を集約することでICG蛍光法の課題を克服することが優先されるべきであると考えている.
また肝区域境界の術中ナビゲーションを目的として投与するICGの蛍光発光と術前検査時に投与して腫瘍に遺残したICGの蛍光発光は現時点では区別が不可能(図5A)で,腫瘍の位置が切離面に近い症例では誤認の可能性がある(図5B)ため,術前シミュレーションや術中超音波検査との併用が必須である.将来的には腫瘍特異的に集積する別の蛍光物質の開発やそれに付随する医療機器開発により,これらの差別化が可能となることが期待される(図5C).
今後はMIPSを用いたリアルタイムナビゲーションが肝切除以外の領域へ広がることが予測され,すでにICG蛍光法の有用性が高いとされる乳腺外科のセンチネルリンパ節同定における有用性14)や肝芽腫の肺転移巣同定における有用性15)については当施設より報告されている.

X.おわりに
ICG蛍光法を用いた生体内イメージングによる手術支援はここ数年で大きな進歩を遂げてきたが,今回われわれが開発したMIPSによりリアルタイムナビゲーションを継続的に使用することが可能となった.近い将来,本機器の商品化により多くの施設での使用経験が蓄積され,安全で精緻な肝切除の実現と同時に,ICG蛍光法が新たな時代を迎えることを目指したい.
謝 辞
本研究は国立研究開発法人日本医療研究開発機構(AMED)の産学連携医療イノベーション創出プログラム(ACT-M)の支援によって行われた.
利益相反
研究費:パナソニック株式会社
文献
1) Makuuchi M, Hasegawa H, Yamazaki S: Ultrasonically guided subsegmentectomy. Surg Gynecol Obstet, 161: 346-350, 1986.
2) Takasaki K: Glissonean pedicle transection method for hepatic resection:a new concept of liver segmentation. J Hepatobiliary Pancreat Surg, 5: 286-291, 1998.
3) Tani K, Shindoh J, Akamatsu N, et al.: Management of disappearing lesions after chemotherapy for colorectal liver metastases:Relation between detectability and residual tumors. J Surg Oncol, 117: 191-197, 2018.
4) Landsman ML, Kwant G, Mook GA, et al.: Light-absorbing properties, stability, and spectral stabilization of indocyanine green. J Appl Physiol, 40: 575-583, 1976.
5) Aoki T, Yasuda D, Shimizu Y, et al.: Image-guided liver mapping using fluorescence navigation system with indocyanine green for anatomical hepatic resection. World J Surg, 32: 1763-1767, 2008.
6) Ishizawa T, Fukushima N, Shibahara J, et al.: Real-time identification of liver cancers by using indocyanine green fluorescent imaging. Cancer, 115: 2491-2504, 2009.
7) Ishizawa T, Bandai Y, Ijichi M, et al.: Fluorescent cholangiography illuminating the biliary tree during laparoscopic cholecystectomy. Br J Surg, 97: 1369-1377, 2010.
8) Cusin F, Fernandes Azevedo L, Bonnaventure P, et al.: Hepatocyte concentrations of indocyanine green reflect transfer rates across membrane transporters. Basic Clin Pharmacol Toxicol, 120: 171-178, 2017.
9) Miyata A, Ishizawa T, Tani K, et al.: Reappraisal of a dye-staining technique for anatomic hepatectomy by the concomitant use of indocyanine green fluorescence imaging. J Am Coll Surg, 221:e27-36, 2015.
10) Ishizawa T, Masuda K, Urano Y, et al.: Mechanistic background and clinical applications of indocyanine green fluorescence imaging of hepatocellular carcinoma. Ann Surg Oncol, 21: 440-448, 2014.
11) Aoki T, Murakami M, Koizumi T, et al.: Determination of the surgical margin in laparoscopic liver resections using infrared indocyanine green fluorescence. Langenbecks Arch Surg, 2018. doi:10.1007/s00423-018-1685-y.
12) Nishino H, Hatano E, Seo S, et al.: Real-time navigation for liver surgery using projection mapping with indocyanine green fluorescence:development of the novel Medical Imaging Projection System. Ann Surg, 267: 1134-1140, 2018.
13) Saito S, Yamanaka J, Miura K, et al.: A novel 3D hepatectomy simulation based on liver circulation: application to liver resection and transplantation. Hepatology, 41: 1297-1304, 2005.
14) Takada M, Takeuchi M, Suzuki E, et al.: Real-time navigation system for sentinel lymph node biopsy in breast cancer patients using projection mapping with indocyanine green fluorescence. Breast Cancer, 25: 650-655, 2018.
15) Chen-Yoshikawa TF, Hatano E, Yoshizawa A, et al.: Clinical application of projection mapping technology for surgical resection of lung metastasis. Interact Cardiovasc Thorac Surg, 25: 1010-1011, 2017.
PDFを閲覧するためには Adobe Reader が必要です。